|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Alkalmazott Biotechnológia és Élelmiszertudományi Tanszék
Témavezető: Dr. Vértessy G. Beáta
A dUTPáz izoformák génkifejeződésének vizsgálata
A kutatási téma néhány soros bemutatása
A dUTPáz a nukleotid-metabolizmusban és a genomi integritás fenntartásában részt vevő kulcsfontosságú enzim, amely egy ígéretes rákterápiás célpont. Kutatásom során a dUTPáz izoformáinak kifejeződését vizsgálom RT-qPCR módszerrel rákos és normál humán sejtekben, egérsejtekben, valamint egérmodellben. A génkifejeződés mértékét meghatározom a sejtciklus különböző fázisaiban, valamint szérummentes táppal történő éheztetés hatására. Eredményeim hozzájárulhatnak a dUTPáz gátlását célzó kemoterápiás kezelések hatásosságának növeléséhez.
A kutatóhely rövid bemutatása
Munkámat a BME VBK Alkalmazott Biotechnológia és Élelmiszertudományi Tanszéken végzem Prof. Dr. Vértessy G. Beáta témavezetésével. Kutatócsoportunk a biológia számos területén tevékenykedik, érdeklődésünk középpontjában a dUTPáz enzim és a DNS-ben megjelenő uracilbázisok állnak. Csoportunkat posztdoktorok és PhD hallgatók mellett sok BSc- és MSc-hallgató alkotja, valamint több hazai és nemzetközi kollaborációs partnerrel dolgozunk együtt.
A kutatás történetének, tágabb kontextusának bemutatása
A DNS-t és az RNS-t egyaránt nukleotidok alkotják, azonban a DNS-ben egyrészt dezoxiribóz található, másrészt a timin bázis veszi át az RNS-beli uracil bázis helyét. A dUTPáz a DNS-t alkotó timin bázisok szintézisében vesz részt, ugyanakkor biztosítja, hogy – a DNS-ben hibának számító – uracil ne épüljön be a genomba1,2. Ezen funkciói miatt már a 90-es években lehetséges rákterápiás célpontként tekintettek rá3–5, hiszen a dUTPázra az aktív DNS-szintézist végző, vagyis aktívan szaporodó sejteknek van a legnagyobb szükségük6–10. Számos tanulmány alátámasztja, hogy a dUTPáz védi a rákos sejteket a – szintén timidilát-bioszintézist gátló – 5-fluorouracil (5-FU) és 5-fluorodezoxiuridin (5-FdUr) kemoterápiás szerekkel szemben, illetve nagyobb mértékű expressziója rosszabb prognózist jelez11–23. A rákkutatás ezen területén több jelentős eredmény született; egy kis molekulás gátlószer (TAS-114) jelenleg a klinikai fázis II. vizsgálaton eredményesen túljutott24.
A dUTPáznak az irodalomban két izoformája ismert, melyek azonos reakciót katalizálnak, de eltérő szekvenciával rendelkeznek3,25. Az egyik a sejtmagi, amely a sejtmagban található, a genomunk döntő többségét alkotó DNS felépítéséért felelős. A másik pedig a mitokondriális izoforma, amely a mitokondriumok mindössze 13 fehérjét kódoló, azonban a nyugvó sejtekben is folyamatosan replikálódó DNS-ének szintéziséhez nélkülözhetetlen. Szérummentes táppal történő éheztetés hatására a sejtek kilépnek a sejtciklusból, és nyugvó állapotba kerülnek. Ekkor a sejtmagi izoforma kifejeződése jelentősen lecsökken, míg a mitokondriális izoformáé változatlan marad25.
A kutatás célja, a megválaszolandó kérdések.
Habár számos nagy áteresztőképességű vizsgálatban mérték többek között a dUTPáz expressziós szintjét, ezek a vizsgálatok nem alkalmasak az izoformák expressziójának külön történő meghatározására, csupán az összegüket adják meg. Ismerve a dUTPáz sejtmagi izoformájának kitüntetett jelentőségét, elengedhetetlen az izoformákra irányuló specifikus expressziós adatok ismerete ahhoz, hogy az élettani funkciót megértsük, és ennek alapján terápiás alkalmazást tervezzünk. A humán dUTPáznak az irodalomban csak két izoformája ismert. Jóllehet az elmúlt évek során – szintén nagy áteresztőképességű vizsgálatokban – további két izoforma jelenlétét valószínűsítették mind RNS-, mind fehérjeszinten. A 3. izoforma nem tartalmaz semmilyen lokalizációs szignált, így valószínűsíthetően a sejtek főtömegét képező sejtplazmában marad. A 4. izoforma a sejtmagihoz igen hasonló, csupán pár aminosavban térnek el egymástól az N-terminálison, a génkifejeződés azonban egy másik promóter segítségével történik, így ennek szabályozása eltérő. E két izoformának eddig csak a létezését igazolták, és semmilyen ismerettel nem rendelkezünk ezek élettani vagy patológiás szerepéről. Kutatásom jelenlegi szakaszában a négy dUTPáz-izoforma kifejeződésének mértékét kívánom meghatározni különféle rákos eredetű és normális humán sejtekben, és ezen adatokból tudunk majd következtetni az új izoformák élettani szerepére.
Vizsgálni kívánom továbbá, hogy ezen izoformák kifejeződése miként változik a sejtciklus során, valamint éheztetés hatására. Az utóbbi kérdés arra adhat választ, hogy a nyugvó és aktív sejtosztódást végző sejtek között, illetve az aktívan osztódó, de eltérő fázisban lévő sejtek között milyen különbségek léteznek a dUTPáz különböző izoformáinak kifejeződésében, így rávilágíthat ezen sejtek kemoterápiás szerekkel szembeni ellenállóságára vagy éppen érzékenységére.
Módszerek
A génexpresszió mérésére RT-qPCR módszert, azaz reverz transzkripciót (RT) követő kvantitatív polimeráz láncreakciót használok. Ez a módszer a DNS természetes megkettőzését utánozza, amit a hőmérséklet ciklikus változtatásán keresztül érünk el. Magas hőmérsékleten (95 °C) a DNS két lánca elválik egymástól, majd egy alacsonyabb hőmérsékleten a mérni kívánt DNS-szakasz két végét kijelölő oligonukleotidok – a primerek betapadása, valamint hőstabil polimeráz enzim – segítségével a DNS szintézis történik meg, így mindkét egyszálú DNS-szakasz kétszálúvá egészül ki. Ezután magas hőmérsékleten ismét elválnak a szálak egymástól, így minden ciklusban duplázódik a DNS-szakasz mennyisége, tehát a ciklusszám függvényében exponenciálisan növekszik. A qPCR-reakció nyomon követését egy fluoreszcens festék segítségével végezzük, ami kettős szálú DNS-hez képes kötődni, és a kötődés következtében fluoreszcenciája jelentősen megnő, melyet minden ciklus végén detektálunk. A mennyiségi meghatározás során megállapítjuk, hogy hány ciklus után lép át a fluoreszcencia egy adott küszöbértéket. A különböző mintákban a ciklusszámokat összehasonlítva egy adott DNS-szakasz relatív mennyisége meghatározható.
A génexpresszió mérése azonban adott szekvenciájú messenger RNS-molekulák meghatározását jelenti, ezért az RNS-ek kinyerését követően ezeket átírjuk DNS-re a reverz transzkriptáz enzim segítségével. Az így kapott komplementer DNS (cDNS) használható templátként a qPCR-reakcióban (1. ábra).
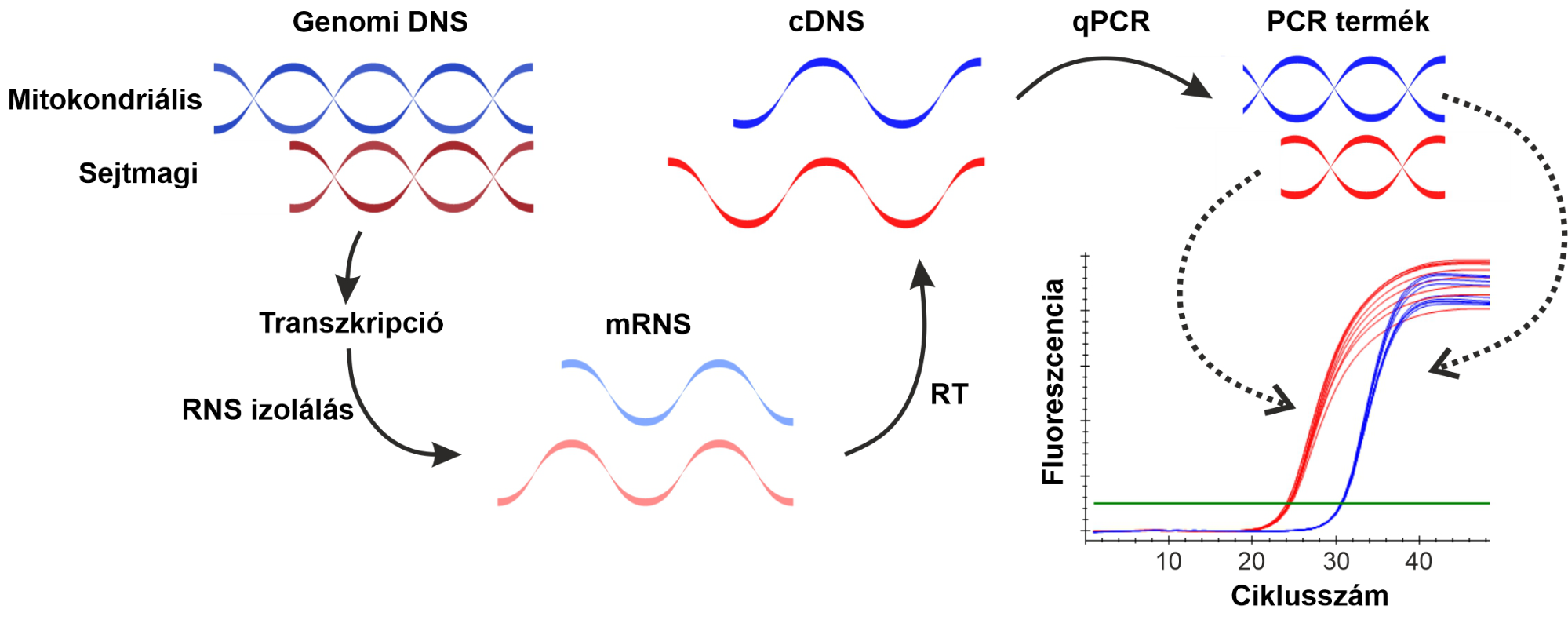
- ábra: A génkifejeződés meghatározásához használt RT-qPCR módszer sematikus ábrázolása
Egy RT-qPCR módszer kifejlesztése idő- és energiaigényes folyamat, mivel számos követelménynek kell megfelelnie. A módszerfejlesztés irányelveit egy 2009-ben megjelent publikáció, a MIQE guidelines jelölte ki26. Mivel a primerek határozzák meg, hogy melyik DNS-szakasz megsokszorozása történjen, ezért a primerek tervezése és kiválasztása igen nagy jelentőséggel bír. Az egyik legfontosabb kontrollált paraméter a primerek betapadási hőmérséklete, ez a reakció specificitását és hatásfokát egyaránt nagymértékben befolyásolja. A primerek koncentrációja szintén optimalizálható a hatásfok maximalizálása érdekében. Az átíráshoz használt RNS optimális mennyisége ugyancsak meghatározandó az inhibíció elkerülése végett. A módszer egyik fő teljesítménymutatója a hatásfok, amely megmutatja, hogy egy ciklus során a DNS-szakaszok hányad része duplázódik meg. A reakció specificitásának ellenőrzése szintén elengedhetetlen; ez agaróz gélelektroforézissel és a termék szekvenálásával tehető meg kezdetben, majd a termékek olvadásgörbéjének ellenőrzése révén követhető nyomon a továbbiakban. Az ismételhetőség és a reprodukálhatóság statisztikai elemzéssel, varianciaanalízissel határozható meg.
A dUTPáz-izoformák expressziójának sejtciklusfüggő vizsgálatához a sejteket 20 órán keresztül RO-3306 CDK1-inhibitor segítségével G2 fázisban szinkronizálom, majd a kezelés után, a felengedést követően a sejteket meghatározott időközönként összegyűjtöm, és a mintákat három kísérlethez készítem elő. Áramlási citometria (FACS) segítségével követem a sejteknek a sejtciklus fázisaiban történő szinkronizált előrehaladását, továbbá RNS-t izolálok az expressziós szintek meghatározása érdekében, valamint Western-blot segítségével vizsgálom a dUTPáz-fehérje mennyiségét.
Eddigi eredmények
Egérben a dUTPáz enzimnek csak két izoformája van jelen, amelyek expresszióját egy korábbi tudományos publikációmban vizsgáltam hím és nőstény egerek különböző szerveiben10. A sejtmagi izoforma azokban a szervekben van jelen nagymértékben, amelyekben aktív sejtosztódás zajlik (lép, csecsemőmirigy, here, petefészek), míg a mitokondriális izoforma kisebb mértékben, de közel állandó szinten expresszál a különböző szervekben (2. ábra). Eredményeim összhangban állnak azzal a kutatással, amelyben kimutatták, hogy éheztetett sejtekben – ahol a szaporodás megáll – a sejtmagi izoforma szintje lecsökken, míg a mitokondriális izoforma szintje változatlan marad a szaporodó sejtekhez képest25.
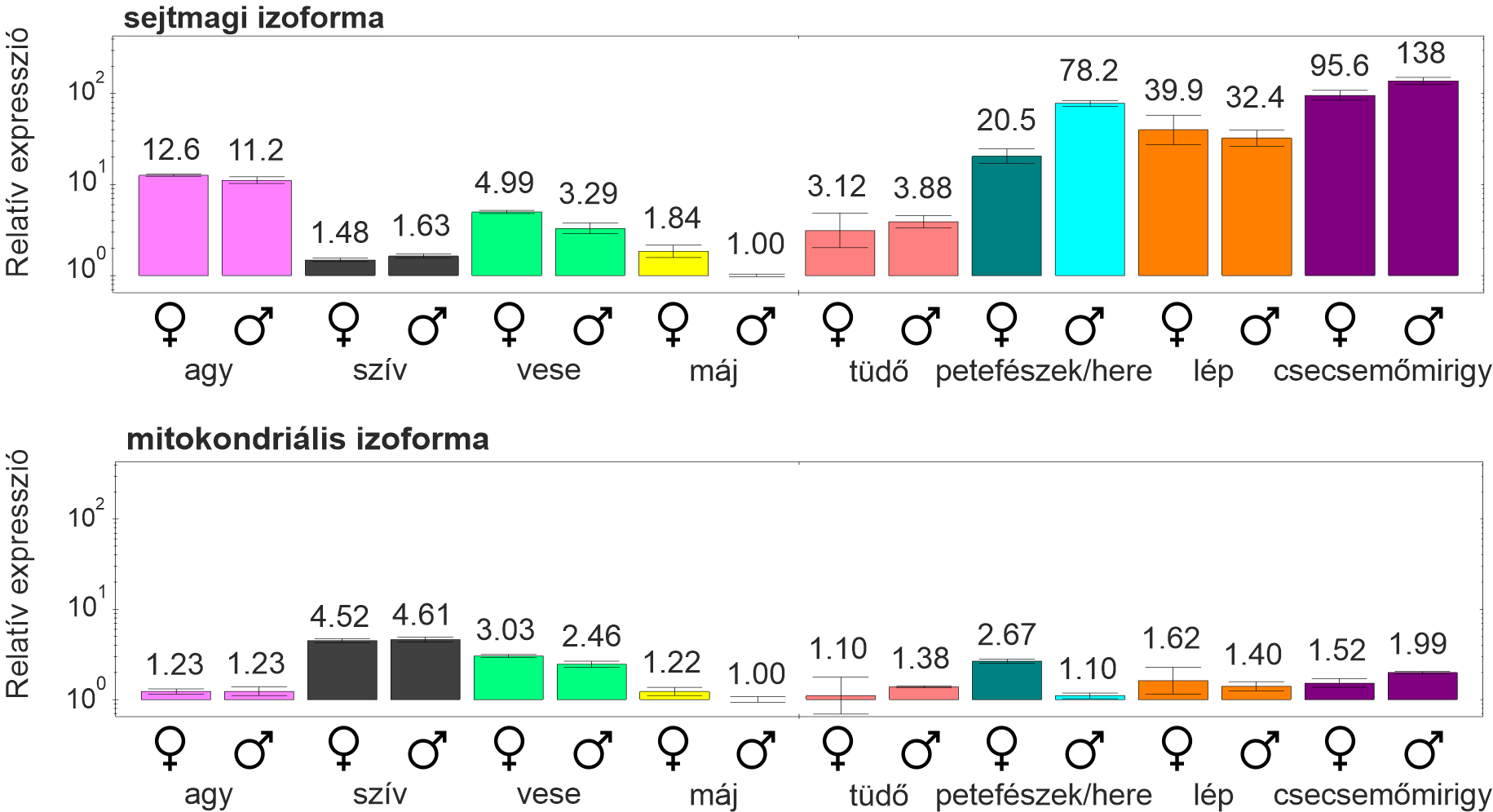
- ábra: A dUTPáz sejtmagi és mitokondriális izoformáinak expressziós szintje hím és nőstény egerek különböző szerveiben
A módszerfejlesztés során szerzett tapasztalataim felhasználásával egy hasonló módszert dolgozok ki a humán dUTPáz-izoformák vizsgálatára. A négy izoforma létezését igazoltam, megterveztem és kiválasztottam a qPCR-reakcióhoz használt primereket, emellett minden esetben meghatároztam az optimális primer betapadási hőmérsékletet és a primerkoncentrációkat, valamint további hat referenciagén expressziójának vizsgálatához is elvégeztem ezeket a lépéseket. A referenciagének olyan gének, amelyeknek kifejeződése viszonylag állandó, független a sejtvonalak sajátosságaitól, így lehetővé teszik, hogy az ezen sejtvonalakban mért eredmények összevethetőek legyenek. A PCR-hatásfok meghatározása elengedhetetlen a génkifejeződés kvantifikálásához, valamint ez a mérőszám a reakció megbízhatóságát is jól jellemzi. Általában 90 és 100% között elfogadható, az általam mért hatásfokértékek minden meghatározni kívánt izoforma és referenciagén esetében 96% és 100% között mozognak. Előzetes eredményeim szerint a HCT-116 humán vastagbélrák eredetű sejtvonalban a sejtmagi izoforma fejeződik ki a legnagyobb mértékben, a mitokondriális izoforma kifejeződése ennek nagyjából 4%-a, a 3. izoformáé 2%-a, míg a 4. izoformáé 0,4%-a (3. ábra).
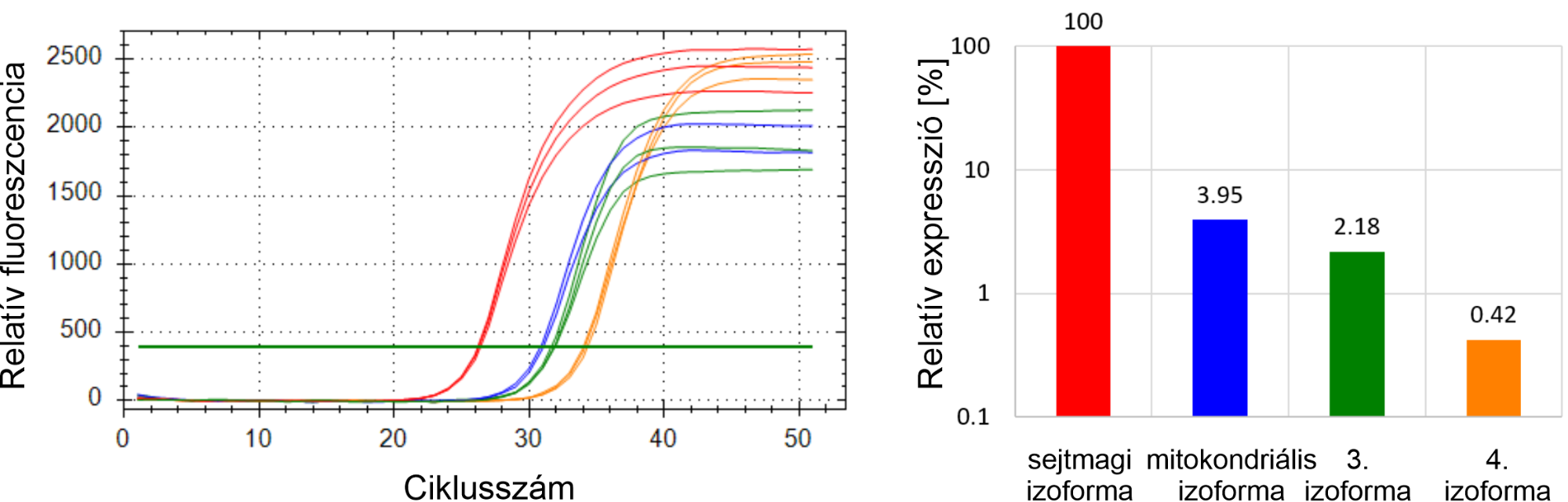
- ábra: A humán dUTPáz négy izoformájának expressziós szintje HCT-116 sejtvonalban
A dUTPáz irodalmában elterjedt feltételezés, hogy a sejtmagi izoforma kifejeződése a sejtciklus S fázisához, vagyis a DNS-szintézishez kötött27. Ennek alapja egy 1997-ben megjelent publikáció, amelyben szérummentes táppal történő éheztetés, és ezt követő felengedés hatására vizsgálták a két ismert izoforma kifejeződését25. Éheztetés hatására hasonló eredményeket kaptam, azonban egy korszerűbb szinkronizálási eljárással, szelektív CDK1-inhibitor alkalmazásával – amely megállítja a sejteket a sejtciklusban, de nem kerülnek nyugvó állapotba – nem tapasztaltam változást a két izoforma kifejeződésében egérsejtekben a sejtciklus különböző fázisai során (4. ábra). Az expressziót fehérje szinten is megvizsgáltam Western-blot alkalmazásával, ahol belső kontrollként az aktin fehérjét, míg ciklusmarkerként a ciklin B1 fehérjét alkalmazom. Az aktin állandó szinten volt jelen, míg a ciklin B1 mennyisége folyamatos csökkenést, majd ismételt emelkedést mutatott a várakozásaimnak megfelelően, azonban a dUTPáz szintje gyakorlatilag változatlan maradt (4. ábra).
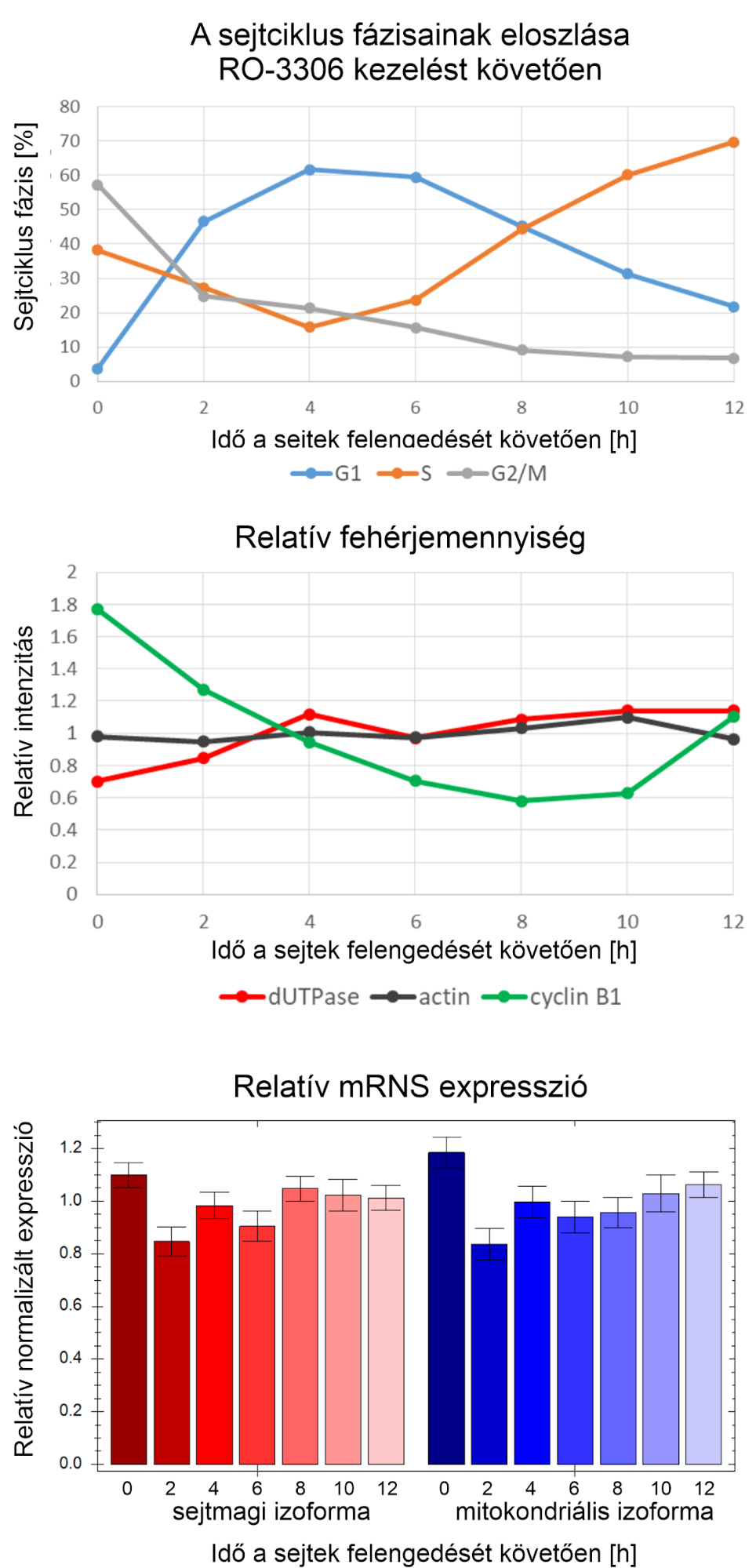
- ábra: A dUTPáz génkifejeződésének vizsgálata fehérje- és mRNS-szinten a sejtciklus különböző fázisaiban egérsejtekben
Várható impakt, további kutatás
Elsőként mértem meg a humán dUTPáz összes izoformájának expresszióját. A fejlesztett RT-qPCR módszer segítségével kívánom összehasonlítani a négy izoforma kifejeződését különféle eredetű rákos, illetve normális sejtekben. Az izoforma-specifikus expressziós szintek vizsgálatával következtethetünk az eddig ismeretlen izoformák szerepére rákos sejtvonalakban. Az egérsejtekben a dUTPáz sejtmagi izoformájának kifejeződése az irodalmi feltevéssel szemben nem függ a sejtciklus fázisától. Ennek cáfolata hozzájárulhat a dUTPáz sejtbeli metabolikus folyamatokban betöltött szerepének alaposabb megértéséhez, így a dUTPáz gátlásán alapuló kemoterápiás kezelések sikerességéhez. Az újonnan kifejlesztett módszerrel továbbá lehetővé válik mind a négy izoforma sejtciklusfüggésének vizsgálatára humán sejtekben is. Eredményeimből két további tudományos publikációt tervezek közölni Q1 besorolású szakfolyóiratokban.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája.
S1. Rácz, Gergely A.; Nagy, Nikolett; Gál, Zoltán; Pintér, Tímea; Hiripi, László; Vértessy, Beáta G. Evaluation of critical design parameters for RT-qPCR-based analysis of multiple dUTPase isoform genes in mice. FEBS Open Bio. Paper: 2211–5463.12654 (2019)
S2. Pálinkás, Hajnalka Laura; Rácz, Gergely Attila; Gál, Zoltán; Hoffmann, Orsolya Ivett; Tihanyi, Gergely; Róna, Gergely; Gócza, Elen; Hiripi, László; Vértessy, Beáta G. CRISPR/Cas9-Mediated Knock-Out of dUTPase in Mice Leads to Early Embryonic Lethality. Biomolecules 9:(4) Paper: 136 (2019)
Linkgyűjtemény.
https://www.uniprot.org/uniprot/P33316
https://www.ncbi.nlm.nih.gov/gene/1854
https://www.uniprot.org/uniprot/A0A0C4DGL3
https://www.uniprot.org/uniprot/H0YNW5
https://en.wikipedia.org/wiki/Reverse_transcription_polymerase_chain_reaction
https://en.wikipedia.org/wiki/Polymerase_chain_reaction
https://en.wikipedia.org/wiki/Reverse_transcriptase
https://en.wikipedia.org/wiki/Agarose_gel_electrophoresis
https://en.wikipedia.org/wiki/Sanger_sequencing
https://en.wikipedia.org/wiki/Melting_curve_analysis
https://en.wikipedia.org/wiki/Analysis_of_variance
https://en.wikipedia.org/wiki/Cyclin-dependent_kinase_1
https://en.wikipedia.org/wiki/Flow_cytometry
https://en.wikipedia.org/wiki/Western_blot
Hivatkozások listája.
- Vértessy, B. G. & Tóth, J. Keeping Uracil Out of DNA: Physiological Role, Structure and Catalytic Mechanism of dUTPases. Acc. Chem. Res. 42, 97–106 (2009).
- Kerepesi, C. et al. Life without dUTPase. Front. Microbiol. 7, 1768 (2016).
- Ladner, R. D., McNulty, D. E., Carr, S. A., Roberts, G. D. & Caradonna, S. J. Characterization of Distinct Nuclear and Mitochondrial Forms of Human Deoxyuridine Triphosphate Nucleotidohydrolase. J. Biol. Chem. 271, 7745–7751 (1996).
- Mcintosh, E. M., Ager, D. D., Gadsden, M. H. & Haynest, R. H. Human dUTP pyrophosphatase: cDNA sequence and potential biological importance of the enzyme. Proc. Natl. Acad. Sci. 89, 8020–8024 (1992).
- Beck, W. R., Wright, G. E., Nusbaum, N. J., Chang, J. D. & Isselbacher, E. M. Enhancement of Methotrexate Cytotoxicity by Uracil Analogues that Inhibit Deoxyuridine Triphosphate Nucleotidohydrolase (dUTPase) Activity. in 97–104 (1986). doi:10.1007/978-1-4684-1248-2_16
- Pardo, E. G. & Gutiérrez, C. Cell cycle- and differentiation stage-dependent variation of dUTPase activity in higher plant cells. Exp. Cell Res. 186, 90–98 (1990).
- Pri-Hadash, A., Hareven, D. & Lifschitz, E. A meristem-related gene from tomato encodes a dUTPase: analysis of expression in vegetative and floral meristems. Plant Cell 4, 149–159 (1992).
- Strahler, J. R. et al. Maturation stage and proliferation-dependent expression of dUTPase in human T cells. Proc. Natl. Acad. Sci. 90, 4991–4995 (1993).
- Hokari, S., Sakagishi, Y. & Tsukada, K. Enhanced activity of deoxyuridine 5′-triphosphatase in regenerating rat liver. Biochem. Biophys. Res. Commun. 108, 95–101 (1982).
- Rácz, G. A. et al. Evaluation of critical design parameters for RT‐qPCR‐based analysis of multiple dUTPase isoform genes in mice. FEBS Open Bio 9, 1153–1170 (2019).
- Canman, C. E., Lawrence, T. S., Shewach, D. S., Tang, H. Y. & Maybaum, J. Resistance to fluorodeoxyuridine-induced DNA damage and cytotoxicity correlates with an elevation of deoxyuridine triphosphatase activity and failure to accumulate deoxyuridine triphosphate. Cancer Res. 53, 5219–24 (1993).
- Canman, C. E. et al. Induction of resistance to fluorodeoxyuridine cytotoxicity and DNA damage in human tumor cells by expression of Escherichia coli deoxyuridine triphosphatase. Cancer Res. 54, 2296–8 (1994).
- Fleischmann, J. et al. Expression of deoxyuridine triphosphatase (dUTPase) in colorectal tumours. Int. J. Cancer 84, 614–617 (1999).
- Romeike, B. F. M. et al. Immunohistochemical detection of dUTPase in intracranial tumors. Pathol. - Res. Pract. 201, 727–732 (2005).
- Wilson, P. M., LaBonte, M. J., Lenz, H.-J., Mack, P. C. & Ladner, R. D. Inhibition of dUTPase Induces Synthetic Lethality with Thymidylate Synthase-Targeted Therapies in Non-Small Cell Lung Cancer. Mol. Cancer Ther. 11, 616–628 (2012).
- Parsels, L. A. et al. Mechanism and pharmacological specificity of dUTPase-mediated protection from DNA damage and cytotoxicity in human tumor cells. Cancer Chemother. Pharmacol. 42, 357–362 (1998).
- Webley, S. D., Welsh, S. J., Jackman, A. L. & Aherne, G. W. The ability to accumulate deoxyuridine triphosphate and cellular response to thymidylate synthase (TS) inhibition. Br. J. Cancer 85, 446–452 (2001).
- Takatori, H. et al. dUTP pyrophosphatase expression correlates with a poor prognosis in hepatocellular carcinoma. Liver Int. 30, 438–446 (2009).
- Kawahara, A. et al. Higher expression of deoxyuridine triphosphatase (dUTPase) may predict the metastasis potential of colorectal cancer. J. Clin. Pathol. 62, 364–369 (2009).
- Nobili, S. et al. Identification of potential pharmacogenomic markers of clinical efficacy of 5-fluorouracil in colorectal cancer. Int. J. Cancer 128, 1935–1945 (2011).
- Webley, S. D., Hardcastle, A., Ladner, R. D., Jackman, A. L. & Aherne, G. W. Deoxyuridine triphosphatase (dUTPase) expression and sensitivity to the thymidylate synthase (TS) inhibitor ZD9331. Br. J. Cancer 83, 792–799 (2000).
- Ladner, R. D. et al. dUTP nucleotidohydrolase isoform expression in normal and neoplastic tissues: association with survival and response to 5-fluorouracil in colorectal cancer. Cancer Res. 60, 3493–503 (2000).
- Wilson, P. M. et al. Novel opportunities for thymidylate metabolism as a therapeutic target. Mol. Cancer Ther. 7, 3029–3037 (2008).
- Yamamoto, N. et al. A randomized, phase 2 study of deoxyuridine triphosphatase inhibitor, TAS-114, in combination with S-1 versus S-1 alone in patients with advanced non-small-cell lung cancer. Invest. New Drugs (2020). doi:10.1007/s10637-020-00930-5
- Ladner, R. D. & Caradonna, S. J. The human dUTPase gene encodes both nuclear and mitochondrial isoforms. Differential expression of the isoforms and characterization of a cDNA encoding the mitochondrial species. J. Biol. Chem. 272, 19072–19080 (1997).
- Bustin, S. A. et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clin. Chem. 55, 611–622 (2009).
- Wilson, P. M., Fazzone, W., LaBonte, M. J., Lenz, H. & Ladner, R. D. Regulation of human dUTPase gene expression and p53-mediated transcriptional repression in response to oxaliplatin-induced DNA damage. Nucleic Acids Res. 37, 78–95 (2009).
