|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Richter Gedeon Nyrt.
Témavezető: Dr. Balogh György Tibor
Gyógyszer-makromolekula kölcsönhatások új analitikai módszerekkel való fizikai-kémiai jellemzése
A kutatási téma néhány soros bemutatása
A gyógyszerhatóanyagok és makromolekulák közötti kölcsönhatás vizsgálatának jelentős szerep jut a gyógyszerkutatás egyes szakaszaiban. Ezen nagy méretű komplexképző segédanyagok (pl. ciklodextrinek [1], fehérjék, liposzómák) alkalmazására szükség lehet rossz vizes oldhatóságú hatóanyagok felszívódásának elősegítésére, biohasznosulásuk és stabilitásuk növelésére [2], de a komplexképzés a hatóanyagok szervezetbeli eloszlását, illetve a hatás helyére való eljutását is nagymértékben befolyásolja (pl. a plazmafehérjékhez való kötődésen keresztül [3]). Éppen ezért kiemelten fontos, hogy rendelkezésre álljanak a komplexképződés vizsgálatára alkalmas korszerű módszerek.
A kutatóhely rövid bemutatása
2005 óta a Richter Gedeon Nyrt. originális kutatásán, illetve 2019 szeptembere óta a BME Kémiai és Környezeti Folyamatmérnöki Tanszéken, a Biomimetikus Technológiák Kutatócsoportban kiterjedten folyik a gyógyszerjelölt vegyületek in vitro modellek segítségével történő fizikai-kémiai és farmakokinetikai jellemzése (oldhatóság, sav/bázis karakter, lipofilitás és permeabilitás vizsgálata), illetve alapkutatások is folynak ebben a témakörben.
A kutatás történetének, tágabb kontextusának bemutatása
A kialakuló komplexek stabilitási viszonyainak, biohasznosulásra gyakorolt hatásának, illetve a kialakult komplex szerkezeti változásainak vizsgálatához megfelelő analitikai módszerek alkalmazására, kidolgozására van szükség. A komplexképzés vizsgálatára alkalmas módszereket alapvetően két fő csoportba sorolhatjuk. Az első a szabad és a komplexált hatóanyagforma elválasztásán alapuló módszerek. Ide tartoznak a különböző kromatográfiás technikák, az affinitás kapilláris elektroforézis, az egyensúlyi dialízis, és tömegspektrometriás módszerek. A másik csoportba olyan eljárások tartoznak, melyek a gyógyszervegyület vagy a komplexképző makromolekula valamilyen fizikai-kémiai sajátságának megváltozását veszik alapul. Ilyenek a fázisoldhatóságon, spektrofotometrián, potenciometrián, NMR-spektroszkópián, konduktometrián, hidrolízis- kinetikán, illetve permeabilitásvizsgálaton alapuló módszerek [4,5].
A kutatás célja, a megválaszolandó kérdések
A kialakuló komplexek erősségének közvetlen hatása van a gyógyszerek szervezeten belüli sorsára és az általuk kifejtett hatásra (farmakokinetikai és farmakodinámiás viselkedésükre), így ezen paraméter ismerete már a gyógyszerkutatás korai szakaszában is létfontosságú. Munkám során a komplexképzés vizsgálatára olyan újfajta, robusztus és költséghatékony modellek kidolgozásával foglalkoztam, melyek segítségével a gyógyszerhatóanyagok és makromolekulák között létrejövő kölcsönhatások tanulmányozására közepes vagy nagy áteresztőképességgel van lehetőség.
A kutatói munka során a következő makromolekula–hatóanyag kölcsönhatások vizsgálatával foglalkoztam:
1) Ciklodextrinek (CD) és ionizációs centrummal rendelkező gyógyszerhatóanyagok között létrejövő zárványkomplexek stabilitási állandóinak meghatározása potenciometriás titrálással a megoszlási állandók (logP) megváltozásán keresztül. A mért stabilitási állandók összehasonlítása a hagyományos mérési módszerekkel kapott értékekkel.
2) In vitro, nem sejtes modell kidolgozása szemcseppek és szemészeti formulációk szaruhártyán keresztül történő felszívódásának vizsgálatára a PAMPA (Parallel Artificial Membrane Permeability Assay) rendszer [6] segítségével. A modell beállítása szemészeti készítményekben alkalmazott segédanyagok, komplexképzők permeabilitásra gyakorolt hatásának vizsgálatára. A modell kidolgozása után nagyszámú hatóanyagon való további tesztelése, az eredmények sejtes modellel (Caco-2) mért permeabilitás adatokkal, illetve fizikai-kémiai paraméterekkel való összehasonlítása a módszer ortogonalitásának tesztelésére. A mért eredmények alapján egy számítógépes (in silico) modell kidolgozása szaruhártya-permeabilitás gyors előrejelzésére.
3) Az UV-pH titrálási technika kiterjesztése hatóanyagok humán szérum albumin (HSA) kötődésének vizsgálatára a proton-disszociációs állandók (pKa) megváltozásán keresztül. Az eredmények összehasonlítása irodalmi, valamint ortogonális mérésekből származó értékekkel (folyadék-kromatográfia (HPLC) [7], gyors egyensúlyi dialízis (RED) [8]), illetve számítógépes (in silico) molekulamodellezés eredményeivel.
4) Orrnyálkahártyán át történő (intranazális) adagolási céllal fejlesztett, közvetlenül a központi idegrendszerben (CNS) ható nem szteroid gyulladáscsökkentő hatóanyagot (meloxikám) tartalmazó HSA-nanorészecskék permeabilitás- és kioldódásvizsgálata.
Módszerek
1) A CD–gyógyszerhatóanyag-komplexek stabilitási állandóinak vizsgálatára különbségi potenciometriás titrálást alkalmaztam, mely segítségével meghatároztam két bázikus (bupropion, prometazin) és két savas karakterű hatóanyag (diklofenák, ketoprofén) megoszlási állandóját (logP), valamint látszólagos megoszlási állandóit (logPapp) különböző (2-hidroxipropil)-ß-CD (HPBCD) koncentrációk mellett. A vizsgálatok során a kétfázisú rendszerben jelenlevő oktanol CD-nel alkotott komplexeinek jelenléte miatt a fázisarányok korrekcióját is figyelembe vettem a modellben.
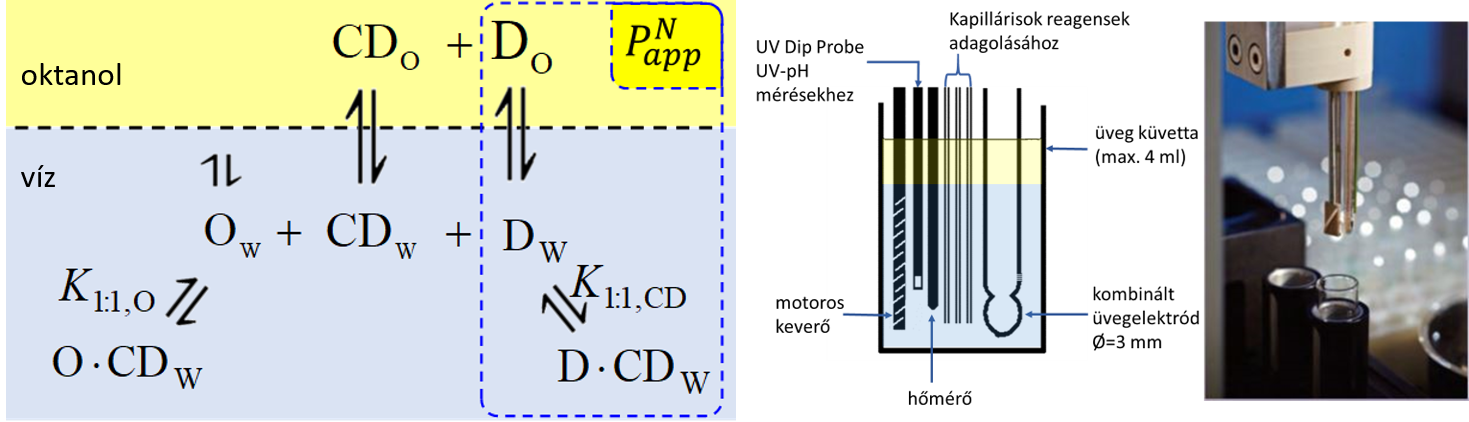
1.ábra Az oktanol–víz megoszlási rendszerben a gyógyszerhatóanyag (D), ciklodextrin (CD) és oktanol (O) molekulák között fellépő egyensúlyi folyamatok és a titrálás során használt SiriusT3 berendezés mérőcellája.
2) A szemcseppek, és szemészeti formulációk hatóanyagainak vizsgálata során a szendvicsszerűen elrendezett, 96 lyukú PAMPA plate-rendszer mérési körülményeit (membrán lipidösszetétele, koszolvens jelenléte, puffer) optimalizáltam a szaruhártya- permeabilitás mérésére, ex vivo, nyúl permeabilitási értékeinek felhasználásával. A 4 órás, 35 °C-on történő inkubálás után a donor és fogadó oldalon kialakuló hatóanyag-koncentrációkat folyadék-kromatográfiás módszerrel (HPLC-DAD) meghatározva szaruhártya-specifikus permeabilitási értékeket számoltam.
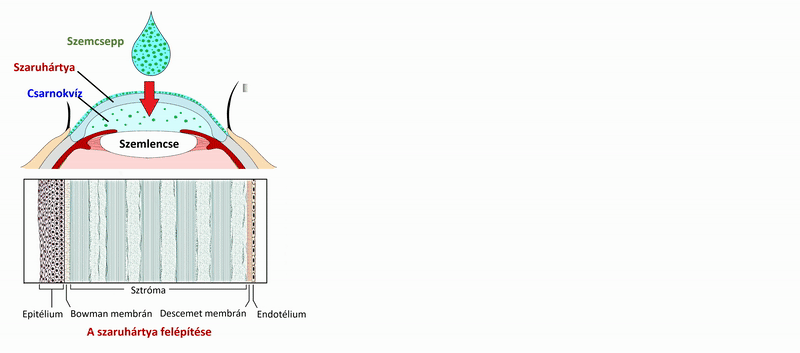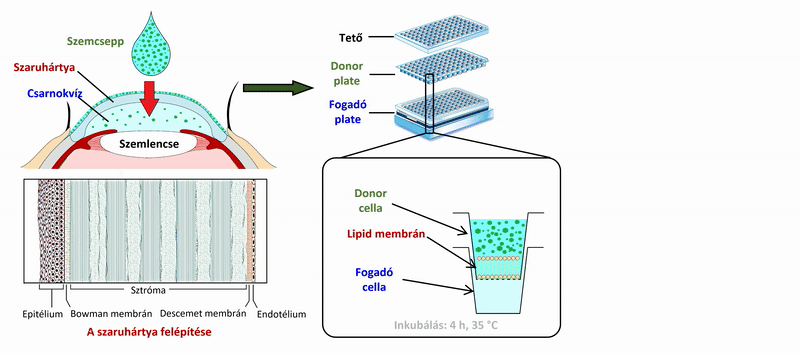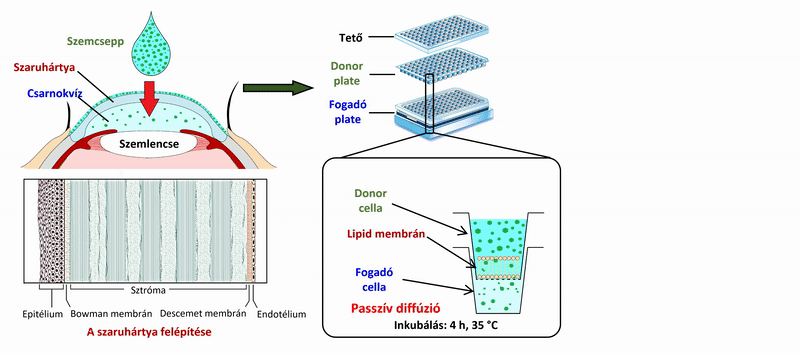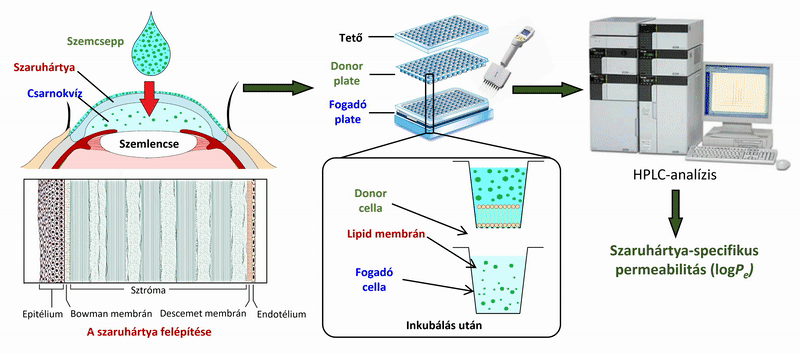
2. ábra. A szaruhártya-permeabilitás mérésének vázlatos folyamatábrája a PAMPA rendszer használatával.
Az optimált modellel szemcseppek, és szemészeti formulációk vizsgálatát is elvégeztem. Nagyszámú hatóanyagra mért permeabilitásadatok alapján pedig egy in silico modellt is kidolgoztunk PLS- (parciális legkisebb négyzetek regresszió) alapú módszert alkalmazva melyben fizikai-kémiai deszkriptorokat és molekuláris ujjlenyomatokat használtunk.
3) A hatóanyagok humán szérum albumin- (HSA-) kötődésének meghatározására az UV-pH titrálási mérést alkalmaztuk, korábbi hatóanyag–CD komplexekkel történő tapasztalataink alapján [EP9]. A technika segítségével pH-függő abszorbancia-spektrummal rendelkező molekulák pKa értéke gyorsan, robusztusan meghatározható. A rendszerben HSA jelenlétében az UV-pH titrálás során kapott abszorbanciaspektrumok, és így a mért pKa értékek is megváltozhatnak, melynek mértékéből következtethetünk a hatóanyag kötődési erősségére. Az így kapott eredményeinket hagyományos módszerekkel, immobilizált HSA-t tartalmazó oszlopon kromatográfiás technikával, gyors egyensúlyi dialízises mérések, illetve néhány hatóanyag esetében in silico molekuláris dokkolás eredményeivel is összevetettük.
4) A Szegedi Tudományegyetemmel való együttműködés keretein belül az általuk előállított HSA-nanorészecskék fizikai-kémiai jellemzésébe kapcsolódtunk be. A kioldódási profilt az orrnyálkahártyának megfelelő 5,6-os pH-n, a RED plate féligáteresztő membrános rendszerében mértük. A permeabilitásméréseket a PAMPA rendszerben határoztuk meg (donor/fogadó oldali pH 5,6/7,4, membrán: 2,7 m/V% foszfatidilkolin + 1,3 m/V% koleszterin dodekánban feloldva, inkubálás: 37 °C, 4 óra). A MEL-koncentráció meghatározása mindkét esetben HPLC-DAD-technikával történt.
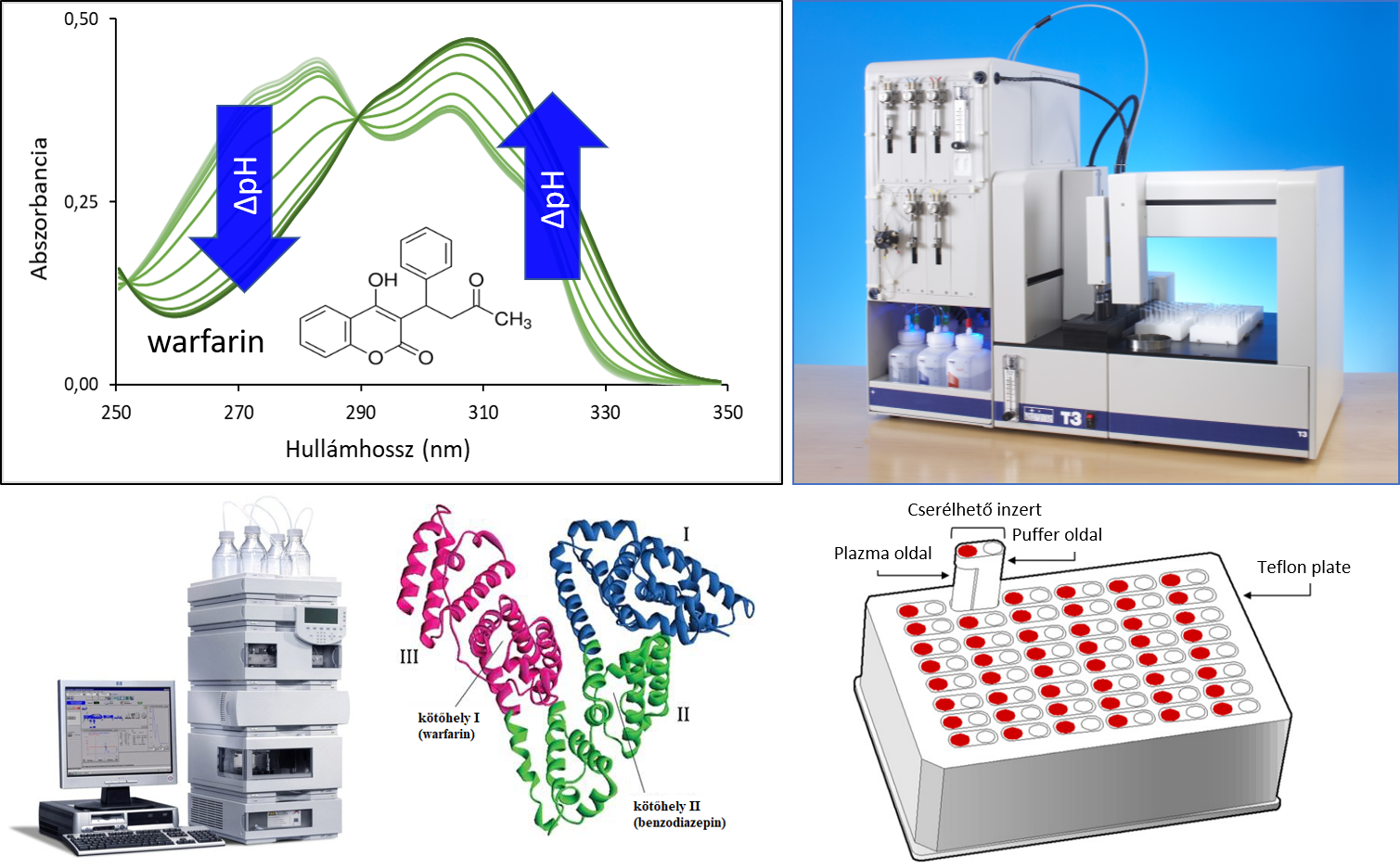
3.
ábra. A HSA kötődés mértékének meghatározására használt technikák: UV-pH
titrálás (fent), immobilizált HSA-oszlopon történő HPLC-s mérés és gyors
egyensúlyi dialízis (RED) (lent).
Eddigi eredmények
1) A különbségi potenciometrikus titrálások esetében a mérési pontok alapján megadhatók a titrálás ún. Bjerrum-függvényei, melyek jól mutatják a mérhető proton-disszociációs állandókban (pKa) tapasztalható különbségeket a tisztán vizes, az oktanol–víz, illetve ezekkel analóg, de vizes fázisukban HPBCD-t tartalmazó rendszerek között. A víz, illetve az oktanol–víz-rendszerben mért pKa, illetve poKa értékekből a Henderson–Hasselbalch-egyenlet segítségével levezetve, kiszámíthatók a megoszlási hányadosok a HPBCD-t tartalmazó, és az anélküli rendszerekben (logPapp és logP) (4. ábra).
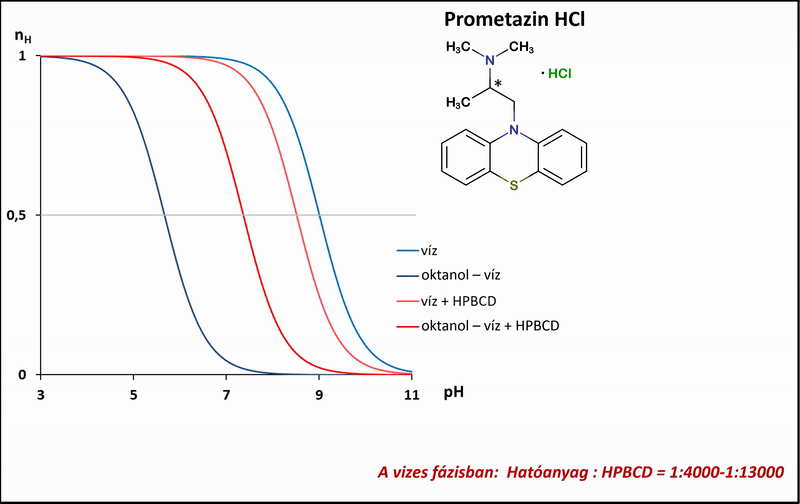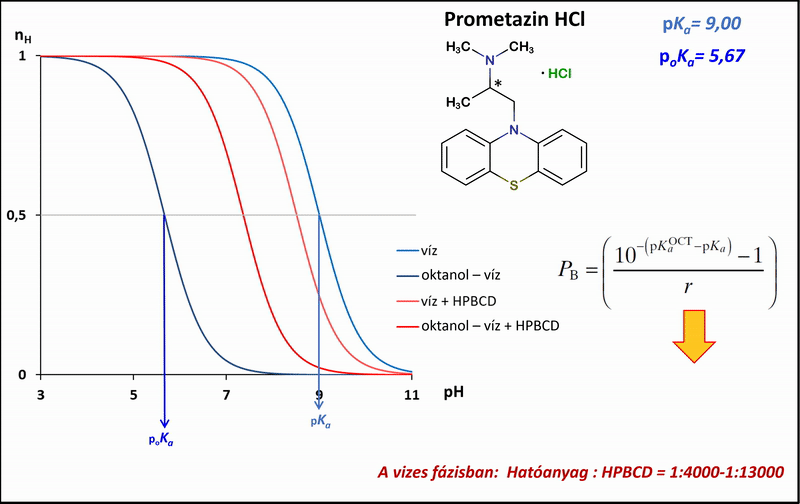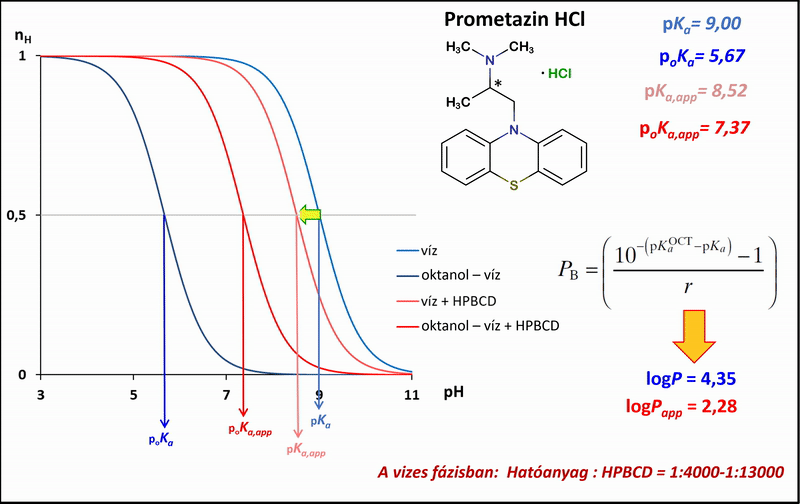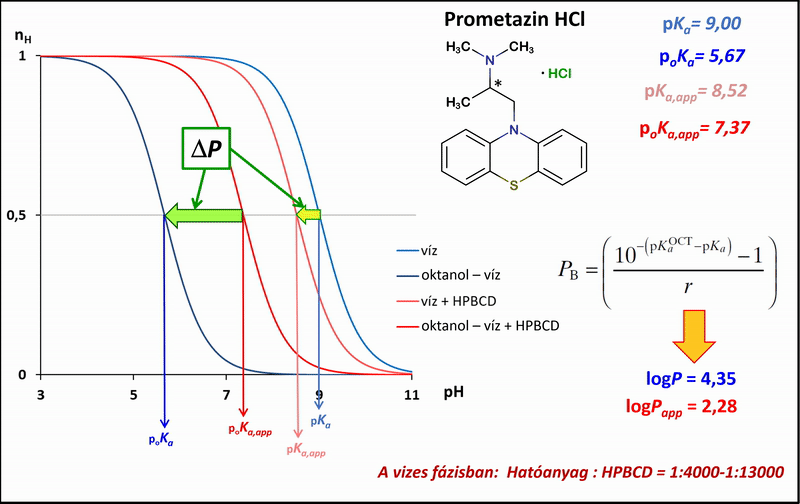
4. ábra: A potenciometrikus különbségi titrálás Bjerrum-függvényei víz, illetve oktanol–víz-rendszerben HPBCD jelenlétében és anélkül
A látszólagos megoszlási hányadosokat többféle HPBCD-koncentráció mellett lemérve, azok reciprokát a HPBCD-koncentráció függvényében ábrázolva a mérési pontokra lineárist illeszthetünk (5. ábra). A lineáris meredekségéből a hatóanyag–HPBCD-komplex stabilitási állandója (K1:1,CD) az 1. ábrán bemutatott egyensúlyi folyamatok figyelembevételével a következő egyenletekkel adhatók meg:
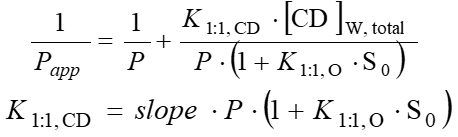
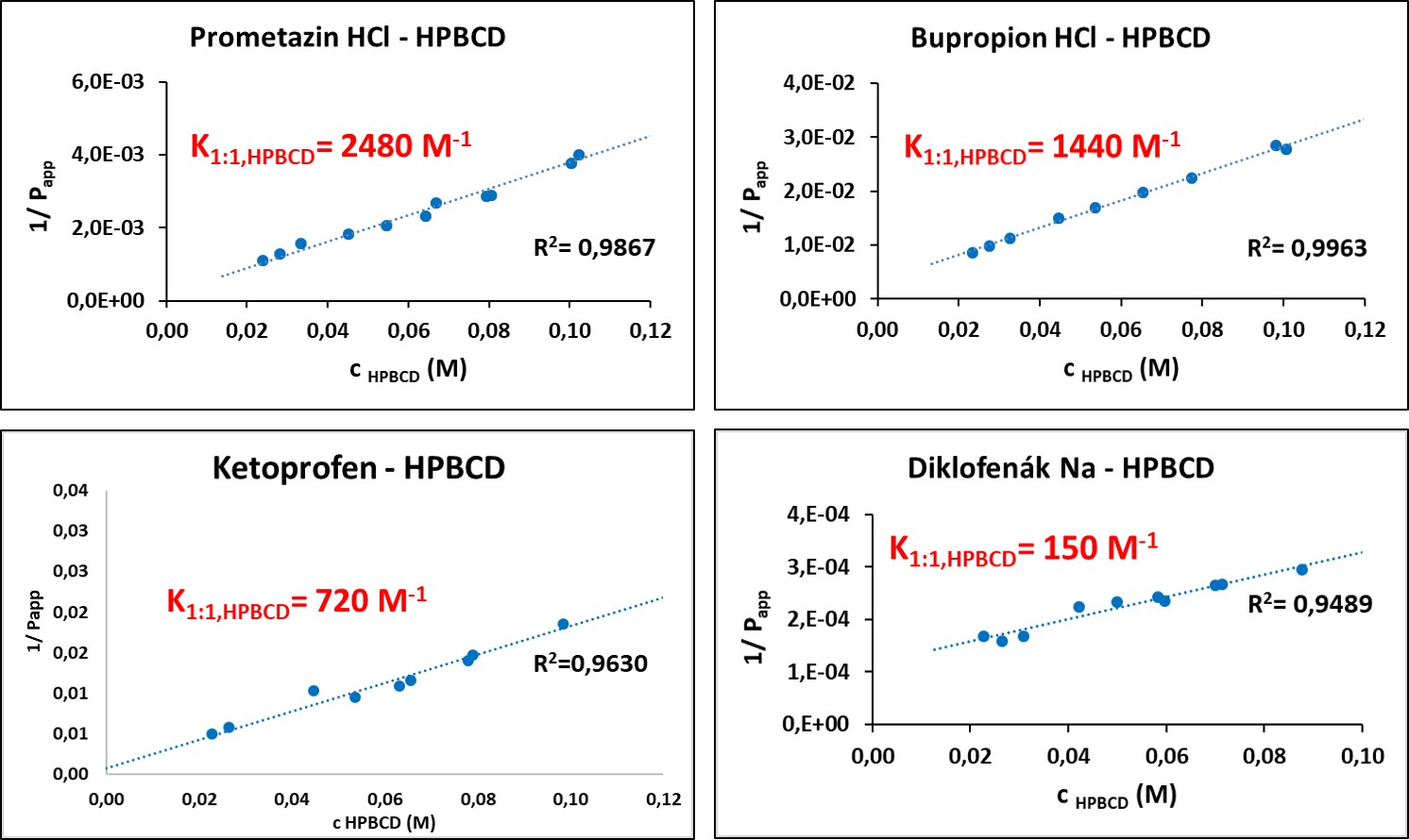
5. ábra: Komplex stabilitási állandók oktanol–víz megoszlásiállandó-változása alapján történő meghatározása a négy vizsgált hatóanyagra.
Eredményeinket ortogonális mérési módszerekkel összehasonlítva azonos nagyságrendű stabilitási állandókat kaptunk, így elmondhatjuk, hogy módszerünk alkalmazható hatóanyag-CD-komplexek stabilitási állandóinak meghatározására [P5].
2) A szaruhártyán történő permeabilitásvizsgálatra alkalmas mérési körülményeket számos modellbeállításban vizsgáltuk (1. táblázat). Optimálisnak a koszolvens használata nélküli, egykomponensű lipidet (PC – foszfatidilkolin), és csökkentett lipidoldószert tartalmazó membrán bizonyult (Modell F1), a szaruhártya összetételéhez hasonló lipidkeverék használata nem hozott javulást a modellben (Modell F2).
1. táblázat: A cornea-PAMPA-modell optimalizálási lépéseinek eredményei
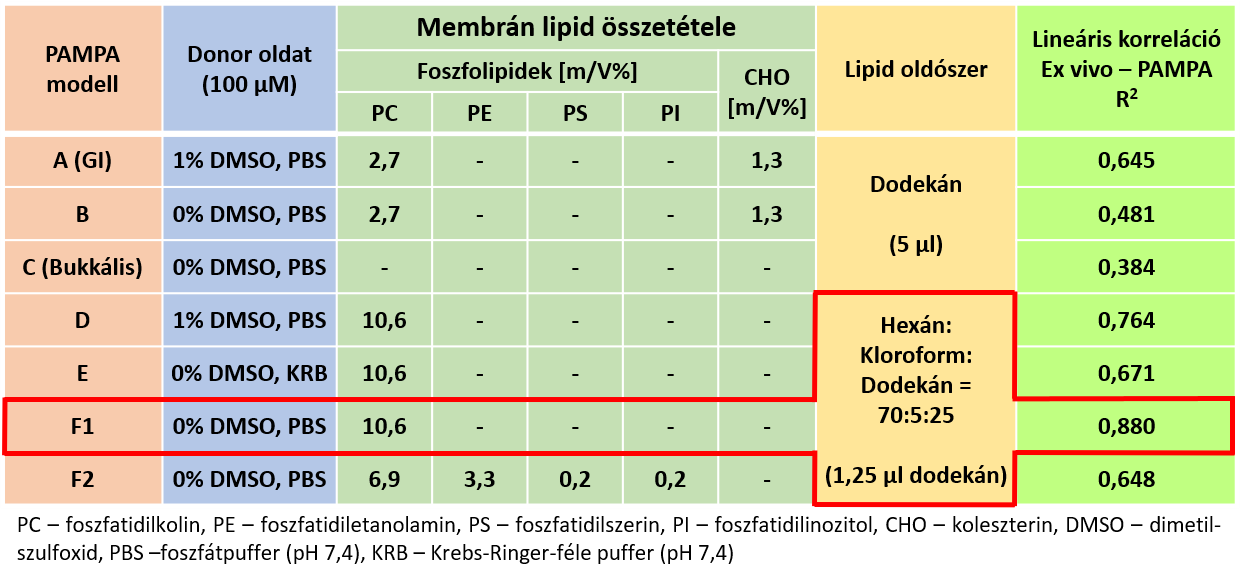
Az optimalizált modellt felhasználva szemcseppek segítségével megmutattuk, hogy a kidolgozott modell alkalmas formulációk mérésére is. Az eredmények alapján elmondható, hogy az általunk alkalmazott hígítási lépések jól modellezték a könny és a pislogás hígítási effektusát is (6. ábra) [P4].
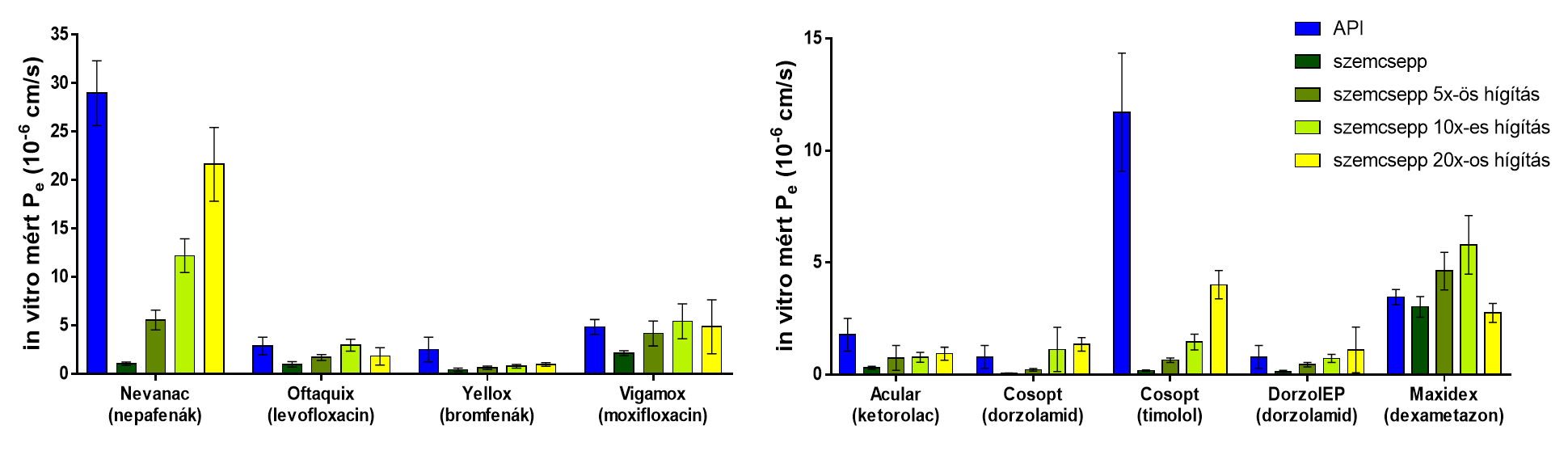
6.
ábra: A cornea-PAMPA-modell vizsgálata kereskedelmi forgalomban kapható
szemcseppeken
A modell segítségével nagyszámú hatóanyag szaruhártyapermeabilitás-értékeit meghatározva megállapítottuk, hogy a különböző fizikai-kémiai deszkriptorok önmagukban nem képesek a modellünkkel elérhető jóságú szaruhártya-permeabilitás előrejelzésére [P3]. A permeabilitásadatokra építve létrehoztunk egy in silico predikciós modellt is, mely a jövőben gyors és robusztus módja lehet a szaruhártya-permeabilitás előrejelzésének [P6].
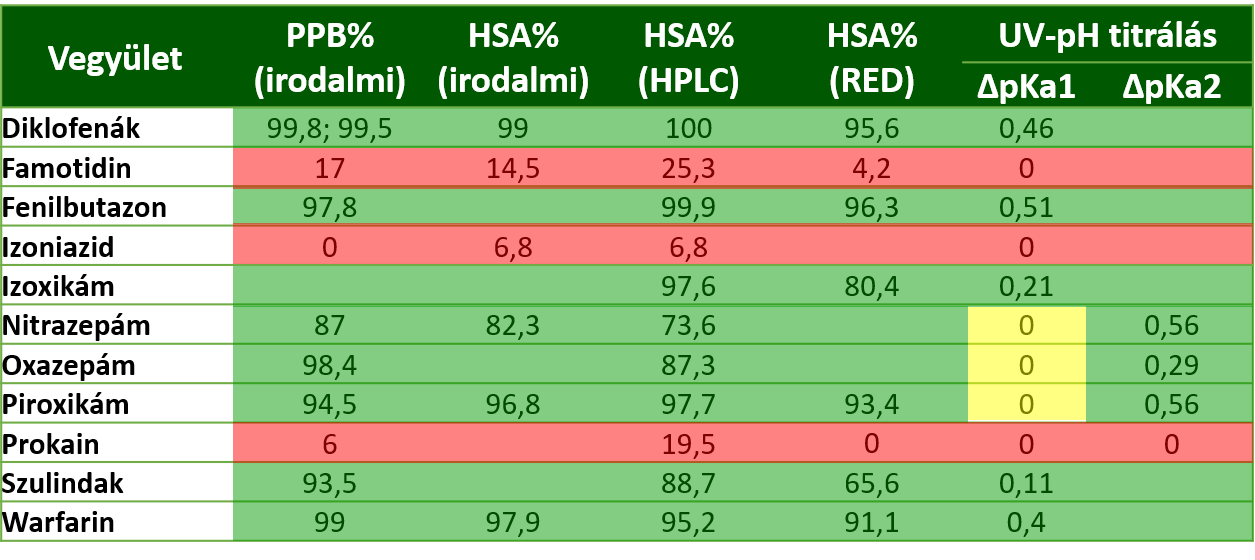
3) A szérum albuminhoz erősen kötődő hatóanyagok esetében UV-pH titrálás során jelentős változásokat figyeltünk meg a hatóanyagok pKa értékeiben, míg a gyengén kötődő hatóanyagok esetében ilyen nem volt tapasztalható (2. táblázat). Több pKa értékkel rendelkező molekulák esetén (pl. nitrazepám) az eltolódások eltérő mértékéből a HSA-val való kölcsönhatás helyére is tudtunk következtetni, melyet az in silico molekulamodellezés eredményei is alátámasztottak (7. ábra).
2. táblázat: Az immobilizált HSA-oszlopon történő HPLC-s, gyors egyensúlyi dialízises és UV-pH titrálási mérések eredményei
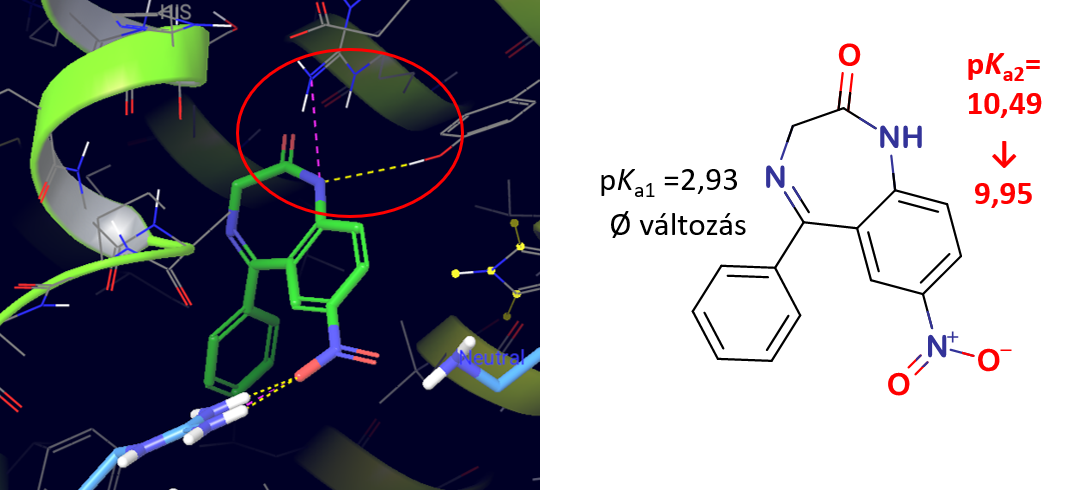
7. ábra: A molekuláris dokkolás során generált kötőmód, és az UV-pH-titrálással mért pKa-változások a nitrazepám molekulájának esetében
Az eredmények alapján elmondható, hogy az UV-pH-titrálási technika kiterjeszthető a HSA-kötődés vizsgálatára, és a hagyományos módszerekhez képest többlet szerkezeti információ is nyerhető vele [P1].
4) A HSA-t, meloxikámot (MEL) és felületaktív anyagot (Tween 80) optimalizált arányban tartalmazó nanorészecske (MEL-HSA-Tween) kioldódását és permeabilitását összehasonlítva a felületaktív anyagot nem tartalmazó nanorészecske (MEL-HSA), illetve por MEL esetében kapott eredményekkel látható, hogy a nanorészecskék mind a kioldódásprofil-, mind a permeabilitásmérések esetén meghatározott fluxus alapján sokkal jobb farmakokinetikai tulajdonságokkal rendelkeznek (8. ábra). A legjobb eredményeket a Tween-t is tartalmazó formuláció esetén kaptuk, így ez a készítményforma ajánlható intranazális adagolás céljára a jobb biohasznosulás elérésének reményében [P2].
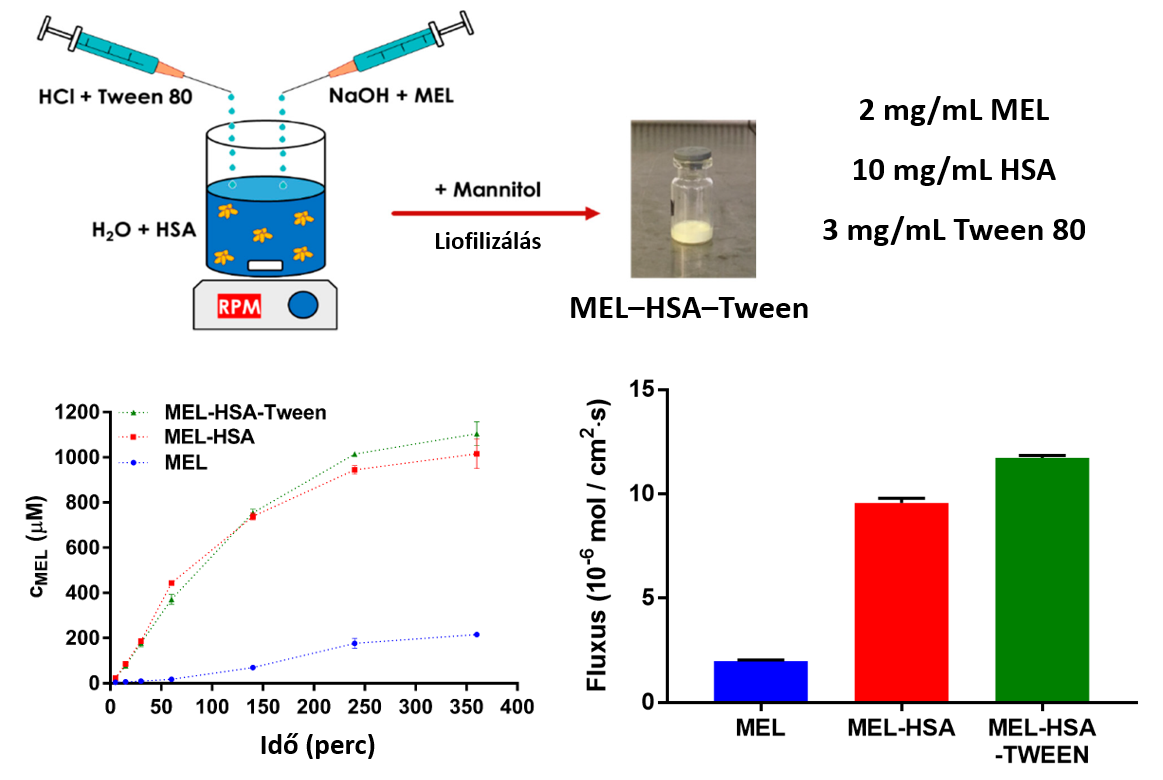
8. ábra: A HSA-nanorészecskék (MEL-HSA, MEL-HSA-Tween) és por meloxikám (MEL) kioldódásprofiljai és a permeabilitásmérések során meghatározott fluxusok
Várható impakt, további kutatás
Az eddigi eredményekből megjelent publikációkat, posztereket a hazai és nemzetközi szakmai közösség is érdeklődéssel fogadta.
A megoszlási hányados változásán alapuló, komplexstabilitási állandó meghatározására használt módszer egy új, a hagyományos módszerektől független eszközt adott a kutatóknak ezen vizsgálatok elvégzésére.
Kutatócsoportunkban a corneal-PAMPA-modellt jelenleg is használjuk terápiás készítmények formulációjának kidolgozására, és a témában további nemzetközi publikációk is előkészületben vannak [P6, P7].
Az UV-pH-titrálási technika új utat nyithat a vezérmolekula-optimálási lépés támogatására, magas HSA-kötődésű gyógyszerjelöltek kiszűrésére, szerkezetük hatékony módosítására az alacsonyabb albuminkötődés eléréséhez, valamint fajspecifikus kötődés vizsgálatára.
A meloxikámtartalmú HSA-nanorészecskék intranazális alkalmazása ígéretes lehetőségnek tűnik a hatóanyag közvetlenül a központi idegrendszerbe való bejuttatására, melyet a Szegedi Tudományegyetemen végzett in vivo állatkísérletek is alátámasztottak.
Saját publikációk, hivatkozások, linkgyűjtemény
Közvetlenül kapcsolódó saját publikációk listája.
[P1] Dargó, G., Bajusz, D., Simon, K., Müller, J., Balogh, Gy.T., Human Serum Albumin Binding in a Vial: A Novel UV-pH Titration Method To Assist Drug Design. Journal of Medicinal Chemistry, 2020, 63, 1763–1774. IF = 6,205
[P2] Katona, G., Balogh, Gy.T., Dargó, G., Gáspár, R., Márki, Á., Ducza, E., SztojkovIvanov, A., Tömösi, F., Kecskeméti, G., Janáky, T., Kiss, T., Ambrus, R., Pallagi, E., Szabó-Révész, P., Csóka, I., Development of meloxicam-human serum albumin nanoparticles for nose-to-brain delivery via application of a quality by design approach. Pharmaceutics, 2020, 12, 97. IF = 4,421
[P3] Vincze, A., Dargó, G., Balogh Gy. T., Cornea-PAMPA as an orthogonal in vitro physicochemical model of corneal permeability, Periodica Polytechnica Chemical Engineering, 2020, 64 (3), 384–390. IF = 1,257
[P4] Dargó, G., Vincze, A., Müller, J., Kiss, H. J., Nagy, Z. Zs., Balogh, Gy. T., Corneal-PAMPA: A novel, non-cell-based assay for prediction of corneal drug permeability, European Journal of Pharmaceutical Sciences, 2019, 128, 232–239. IF: 3,616
[P5] Dargó, G., Boros, K., Péter, L., Malanga, M., Sohajda, T., Szente, L., Balogh, Gy. T., Novel medium-throughput technique for investigating drug-cyclodextrin complexation by pH-metric titration using the partition coefficient method, International Journal of Pharmaceutics, 2018, 542 (1–2), 100-107. IF: 3,645
[P6] Vincze, A., Dargó, G., Rácz, A., Balogh, Gy. T., A corneal-PAMPA-based in silico model for predicting corneal permeability, beküldés előtt
[P7] Dargó, G., Szilágyi, B. Á., Gyarmati, B., Budai Szűcs, M., Szilágyi, A., Balogh, Gy. T., Synthesis, complex formation and corneal permeation of mucoadhesive cyclodextrin-modified thiol-functionalized poly(aspartic acid) formulations of dexamethasone, előkészületben
Egyéb saját publikációk listája.
[EP1] Szabó-Szentjóbi, H., Márton, A., Pál, D., Dargó, G., Szigetvári, Á., Szántay, Cs., Balogh, Gy. T., Tóth, T., Huszthy, P., Synthesis, Fluorescence and NMR Spectroscopic Studies of a Novel Phosphinoxido-18-crown-6 Ether Containing an Anthracene Fluorophore Unit, Periodica Polytechnica Chemical Engineering, 2019, 64:(1), 37–45. IF = 1,257
[EP2] Nagy, S., Fehér, Zs., Dargó, G., Barabás, J., Garádi, Zs., Mátravölgyi B., Kisszékelyi, P., Dargó, Gy., Huszthy, P., Höltzl, T., Balogh, Gy. T., Comparison of Cinchona Catalysts Containing Ethyl or Vinyl or Ethynyl Group at Their Quinuclidine Ring, Materials, 2019, 12:(18), 3034. IF = 3,057
[EP3] Könczöl, Á., Dargó, G., Brief overview of solubility methods: Recent trends in equilibrium solubility measurement and predictive models, Drug Discovery Today: Technologies, 2018, 27, 3–10.
[EP4] Dargó, G., Bölcskei, A., Grün, A., Béni, Sz., Szántó, Z., Lopata, A., Keglevich, Gy., Balogh, Gy. T., Proton dissociation properties of arylphosphonates: Determination of accurate Hammett equation parameters, Journal of Pharmaceutical and Biomedical Analysis, 2017, 143, 101–109. IF: 3,255
[EP5] Németh, T., Dargó, G., Petró, J. L., Petrik, Zs., Lévai, S., Krámos, B., Béni, Z., Nagy, J., Balogh, Gy. T., Huszthy, P., Tóth, T., Synthesis and pKa determination of new enantiopure dimethyl-substituted acridino‐crown ethers containing a carboxyl group: Useful candidates for enantiomeric recognition studies, Chirality: The Pharmacological Biological and Chemical Consequences of Molecular Asymmetry 2017, 29 (9), 522–535. IF: 1,956
[EP6] Borbás, E., Sinkó, B., Tsinman, O., Tsinman, K., Kiserdei, E., Démuth, B., Balogh, A., Bodák, B., Domokos, A., Dargó, G., Balogh, Gy. T., Nagy, Zs. K., Investigation and mathematical description of the real driving force of passive transport of drug molecules from supersaturated solutions, Molecular Pharmaceutics, 2016, 13 (11), 3816–3826. IF: 4,440
[EP7] Kupai, J., Kisszékelyi, P., Rojik, E., Dargó, G., Hegedűs, L., Bezzegh, D., Maszler, P., Szabó, L., Németh, T., Balogh, Gy. T., Huszthy, P., Synthesis and determination of pKa values of new enantiopure pyridino- and piperidino-18-crown-6 ethers” Arkivoc 2016, (IV), 130–151. IF: 1,031
[EP8] Szabó, T., Dargó, G., Szentjóbi, H., Tóth, T., Krámos, B., Izrael, R., Oláh, J., Németh, T., Balogh, Gy. T., Huszthy, P., Synthesis, experimental and theoretical studies on the factors influencing the pKa values of new crown ethers containing a diarylphosphinic acid unit, Tetrahedron, 2016, 72 (52), 8593–8602. IF: 2,651
[EP9] Dargó, G., Balogh, Gy. T., pH-metriás titrálás a fizikai-kémia alapú gyógyszerkémia szolgálatában: ciklodextrin-gyógyszermolekula komplex-képzés- vizsgálata (gyors) UV-pH titrálással, Magyar Kémiai Folyóirat - Kémiai Közlemények (1997-) 2016 122 (2–4), 117–123.
[EP10] Müller, J., Esső, K., Dargó, G., Könczöl, Á., Balogh, Gy. T., Tuning the predictive capacity of the PAMPA-BBB model. European Journal of Pharmaceutical Sciences, 2015. (79), 53–60. IF: 3,756
Linkgyűjtemény.
Hivatkozások listája.
[1] Szente L. Ciklodextrinek: Nanoméretű konténerektől a terápiás eszközökig, Magyar Kémiai Folyóirat - Előadások, 2015., 121. évf., 1. szám, 34-38.
[2] Natalie L. Trevaskis, Susan A. Charman, Ravi M Shanker, William N. Charman, Colin W. Pouton, Christopher J. H. Porter, Hywel D. Williams, Strategies to Address Low Drug Solubility in Discovery and Development, Pharmacological Reviews, 2013, vol. 65, pp. 315–499.
[3] T. Bohnert and L.-S. Gan, Plasma Protein Binding: From Discovery to Development, Journal of Pharmaceutical Sciences, 2013, vol. 102, no. 9, pp. 2953–2994.
[4] Dujuan Lu, Stephen G. Weber, Zhi Chen, High-Throughput Phase-Distribution Method to Determine Drug-Cyclodextrin Binding Constants, Journal of Pharmaceutical Sciences, 2009, vol. 98, 229–238.
[5] K. A. Connors, Binding Constants: The Measurement of Molecular Complex Stability, Wiley-Interscience, 1987.
[6] M.Kansy, F. Senner, K. Gubernator, Physicochemical high throughput screening: parallel artificial membrane permeation assay in the description of passive absorption processes, Journal of Medicinal Chemistry, 1998,41(7), 1007–1010.
[7] K. Valkó, S. Nunhuck, C. Bevan, M. H. Abraham, D. P. Reynolds, Fast gradient HPLC method to determine compounds binding to human serum albumin. Relationships with octanol/water and immobilized artificial membrane lipophilicity, Journal of Pharmaceutical Sciences, 2003, 92(11), 2236–2248.
[8] N. J. Waters, R. Jones, G. Williams, B. Sohal, Validation of a Rapid Equilibrium Dialysis Approach for the Measurement of Plasma Protein Binding, Journal of Pharmaceutical Sciences, 2008, 97(10), 4586–4595.
