|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Nagy Zsombor Kristóf
Elektrosztatikus szálképzéssel előállított amorf szilárd diszperziók vizsgálata és feldolgozása
A kutatási téma néhány soros bemutatása
A gyógyszeripari kutatás és fejlesztés területén az elmúlt néhány évtizedben elszaporodtak a rossz vízoldhatósággal és ezáltal gyenge biohasznosulással bíró hatóanyagok. E tulajdonságok javítására alkalmasak az ún. amorf szilárd diszperziók. Ezen anyagok, anyagrendszerek költséghatékony és kíméletes előállítására kínál megoldást az elektrosztatikus szálképzés. Kutatómunkám során a technológia méretnövelésével, szálképzéssel előállított (nanoszálas) diszperziók karakterizálásával és alkalmazható gyógyszerformává (pl.: tabletta) alakításával foglalkozom.
A kutatóhely rövid bemutatása
Kutatómunkámat a Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszékén végzem, Dr. Nagy Zsombor Kristóf és Dr. Marosi György irányításával, akik több mint 10 éves tapasztalattal bírnak ezen a területen, és számos ide vonatkozó publikáció és néhány szabadalom társszerzői.
A kutatás történetének, tágabb kontextusának bemutatása
A gyógyszeriparban az 1980-as évektől kezdve nagy áteresztő képességű szintetizálási eljárásokat és számítógépes modellezést használnak originális gyógyszermolekulák feltalálására. Ezen módszerek a sejtekben található lipid membránokon könnyen felszívódó és a receptorhoz aktívan kötődő, de rossz vízoldhatóságú vegyületeket hozzák ki találatként. Így az utóbbi néhány évtizedben igen aktív molekulákat fedeztek fel, de nem biztos, hogy gyógyszerkészítmény lesz belőlük. Gyenge oldhatóságuk ugyanis megakadályozza, hogy a hatóanyag a vérkeringésbe kerüljön, és ezáltal kifejthesse a hatását. Így a gyógyszeripar egyik nagy kihívásává vált az újonnan felfedezett, rossz vízoldhatóságú vegyületek formulálása. A korábban feltalált, de alapvetően rossz biohasznosulással rendelkező hatóanyagok újraformulálása (szupergenerikus készítmények) is fontos cél.
Az amorf szilárd diszperziók e probléma kiküszöbölésére születtek [1, 2]. Szilárd diszperzió alatt a hatóanyag polimerben molekulárisan szétoszlatott diszperzióját értjük. Ezen anyagok előállítása során a hatóanyag kristályos formából amorffá alakul át, amelynek jobb a vízoldhatósága. Szilárd diszperziók előállítása lehetséges elektrosztatikus szálképzéssel, amely képes lehet áthidalni a két leggyakrabban alkalmazott technológiához – olvadék extrúzió és porlasztva szárítás – kötődő hátrányokat. Szálképzett anyagok esetén a nanoszálak nagy fajlagos felülete is gyorsítja a kioldódást, a Noyes-Whitney egyenlet szerint [3, 4]. A szálképzést és a szálképzett anyagokat azonban számos előnyük ellenére még nem alkalmazzák a gyógyszeriparban.
A kutatás célja, a megválaszolandó kérdések
A kutatás külföldi és magyar gyógyszergyárakkal együttműködésben valósul(t) meg. Ennek megfelelően arra keressük a választ, hogy az elektrosztatikus szálképzés és az így előállított amorf szilárd diszperziók képesek-e jelentős szerepet betölteni a gyógyszeripari fejlesztésben. Fontos kérdésnek számít, hogy a kutatócsoportunk által kidolgozott nagy sebességű szálképzéssel megfelelő termelékenységet érhetünk-e el. Egy másik nagyon fontos szempont az előállított anyagok fizikai stabilitása. Az amorf anyagok tudniillik tárolás és feldolgozás során hajlamosak visszaalakulni a termodinamikailag stabilabb kristályos formává, amivel elvész legfontosabb előnyük, a megnövekedett oldhatóság. Így a szálképzéssel előállított szilárd diszperziók stabilitását hosszú távon mind a tiszta formában, mind a végleges készítményben ellenőrizni kell.
A munka megkezdése előtt az irodalomban nem állt rendelkezésre publikáció a szálképzett anyag tablettázásáról, mely lépés elengedhetetlen az ipari felhasználáshoz. Célunk az volt, hogy konvencionális tablettákat állítsunk elő a képzett szálak felhasználásával, illetve vizsgáljuk a szálképzett amorf hatóanyag kompatibilitását a hagyományos gyógyszeripari segédanyagokkal.
Módszerek
Nagy sebességű elektrosztatikus szálképzés: A hatóanyag és a polimer szerves oldószeres vagy vizes oldatát egy perisztaltikus pumpával adagoljuk egy nagy sebességgel forgó, rozsdamentes acél szálképző fejbe, amely nagyfeszültségre van kapcsolva. Az elektrosztatikus és centrifugális erőnek köszönhetően a fejből szálak lépnek ki és vékonyodnak el, sokszor a nano mérettartományba. Az oldószer rendkívül gyorsan párolog el, így a hatóanyag kristályosodására nincs idő. A szálak vagy egy földelt gyűjtőlemezen vagy speciális begyűjtéssel (pl.: késes lekaparás) gyűjthetők be.
A szálképzett anyagok és tabletták karakterizálása során a következő analitikai technikákat használtuk fel: pásztázó elektronmikroszkópia, differenciális pásztázó kalorimetria, por-röntgendiffrakció, dinamikus gőzszorpciós vizsgálat, szilárd fázisú NMR spektroszkópia, in vitro kioldódási vizsgálat, Raman spektrometrián alapuló kémiai térképezés, törési szilárdság mérése, szétesési idő mérése, közeli infravörös és Raman spektrometria.
Eddigi eredmények
Az elektrosztatikus szálképzést összehasonlítva az iparban alkalmazott oldószeres technológiával, a porlasztva szárítással, azt mondhatjuk, hogy előbbinél jóval töményebb oldatokkal dolgozhatunk. Így kevesebb oldószer párolog el ugyanannyi szilárd anyag előállítása esetén, ami különös fontossággal bír a gyógyszeripari szabályozások miatt. Ezenkívül nagyobb fajlagos felületű terméket kapunk (nanoszálak), ami gyorsabb kioldódást jelent (1. ábra). Észrevehetjük továbbá, hogy a két szálképzési technológia (egytűs, kis méretű és nagy sebességű elektrosztatikus szálképzés) által előállított anyagok kioldódásában alig van különbség. A nagy sebességű szálképzéssel elért 450 g/h-s termelékenység megfelelőnek tűnik ipari szempontból is. A jövőben ez még tovább is növelhető a szálképző fej méretének és számának variálásával. Ez a kioldódás természetesen sokkal gyorsabb és nagyobb mértékű volt, mint a kristályos hatóanyag oldódása (vagyis a polimerrel alkotott fizikai keveréké).
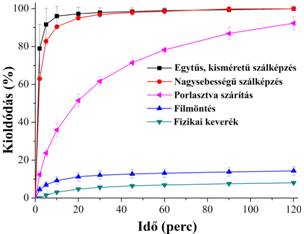
1. ábra: Az itrakonazol nevű hatóanyag kioldódása különböző módon, vinilpirrolidon-vinilacetát-kopolimerrel (PVPVA64) előállított szilárd diszperziójából
Az 1 évig klímaszekrényben tárolt, nagy sebességű szálképzéssel gyártott nanoszálas amorf szilárd diszperziókból hasonlóan szabadult fel az itrakonazol, mint a frissen készített mintákból (kontrollált körülmények, PVPVA64: 25 °C/60% relatív páratartalom, hidroxipropil-metilcellulóz (HPMC): 40 °C/75% relatív páratartalom) (2. ábra).
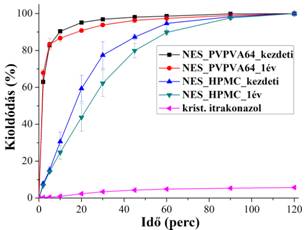
2. ábra: Az itrakonazol nevű hatóanyag kioldódása nagy sebességű szálképzéssel (NES) gyártott szilárd diszperziókból gyártás és 1 év tárolás után
A továbbiakban az itrakonazol és a PVPVA64 alkotta szilárd diszperzió feldolgozhatóságával, tablettává alakíthatóságával foglalkoztunk. A szálképzett anyagot oszcillációs őrlés és hagyományos segédanyagokkal való összekeverés után préseltük tablettává. A gyógyszeripari trendeknek megfelelően optimalizáló kísérlettervezés után állapítottuk meg az ideális préserőt és összetételt. A feldolgozás és az alkalmazott segédanyagok (mannit, mikrokristályos cellulóz, szilícium-dioxid, kroszpovidon és nátrium-sztearil-fumarát) hosszú távon sem okoztak fizikai instabilitást, ahogy azt a változatlan kioldódási profil mutatja (3. ábra). Ezen kívül kémiai degradáció se történt, ugyanis az alkalmazott nagy teljesítményű kromatográfiás módszer csak 0,08%-kal több szennyezőt mutatott ki egy évig tárolt tablettában, mint a kristályos hatóanyagban.
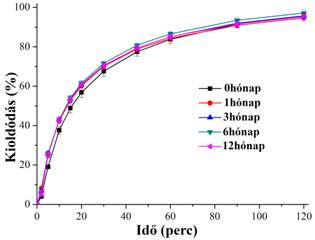
3. ábra: Itrakonazol felszabadulása kontrollált körülmények között tárolt (25 °C/60% relatív páratartalom) szilárd diszperziós tablettákból
A filmbevonás kritikus lépésnek tekinthető amorf szilárd diszperziós tabletták esetén, mivel a víz megnöveli az üvegszerű diszperzióban a hatóanyag mozgékonyságát, ezáltal elősegíti annak kristályosodását. Az általunk készített tabletták filmbevonása azonban nem indukált kristályosodást, hiszen a kioldódási profil változatlan maradt.
A kutatás egyik legérdekesebb részének tekinthető az amorf hatóanyag (jelen esetben itrakonazol) és a konvencionális segédanyagok (in)kompatibilitásának vizsgálata. A magnézium-sztearát egy általánosan használt lubrikáns, hidrofobicitása miatt azonban több esetben rontotta a hatóanyagok kioldódását. Kutatásaink során egy magnézium-sztearát által indukált, korábban még nem leírt jelenséget figyeltünk meg. Nevezetesen, hogy az abból savas kioldóközegben képződő sztearinsav (szilárd fázisú NMR spektroszkópia és Raman spektrometria alapján) másodrendű kötést (hidrogén-kötéseket) alakít ki az itrakonazol triazol gyűrűjével. A képződő asszociátum mindkét tagjának vízoldhatósága alacsony, így az egyszerű amorf itrakonazolhoz képest alacsonyabb mértékű kioldódást tapasztaltunk. Ez a probléma elkerülhető másik lubrikáns (pl.: nátrium-sztearil-fumarát) alkalmazásával, vagy ha a szilárd diszperzióban PVPVA64 helyett HPMC-t alkalmazunk polimer mátrixként. Utóbbi polimer a hidrogén-kötések által stabilizálja a hatóanyagot.
A szálképzett anyagok feldolgozhatóságának általánosíthatóságát bizonyítja, hogy flubendazol tartalmú (mátrixok: hidroxipropil-ß-ciklodextrin és polivinilpirrolidon) szálakat is tablettává alakítottunk direkt préseléssel a jó és gyors kioldódás megtartása mellett. Előremutató kutatásként foghatjuk fel ezen tabletták hatóanyag-tartalmának nem destruktív módon való meghatározását. A két vizsgált technika közül a közeli infravörös spektrometria némileg pontosabb eredményeket szolgáltatott (, mint a Raman), mindazonáltal mindkét módszer alkalmas lehet szilárd diszperziós készítmények hatóanyag-tartalmának meghatározására és a tartalom egységességének követésére.
Várható impakt, további kutatás
A bemutatott kutatáshoz közvetlenül kapcsolódó témákból 6 publikációt már elfogadtak, és egy előkészületben van. Ezek közül 5 a legjobb 25%-hoz (Q1), 3 pedig a legjobb 10%-hoz (D1) tartozik a tudományterületen. Ezen kívül a témához közvetetten kapcsolódó, további 4 publikáció is született. A kutatás újdonsága és ipari fontossága miatt várhatóan a jövőben is hasonló érdeklődés és elfogadás várható a tudományos folyóiratok részéről.
A kutatás folytatása az új gyógyszeripari irányoknak megfelelően fog történni. A legnagyobb előrelátható változás ebben az iparágban a szakaszos gyártásról folyamatosra való átállás. Ennek megfelelően vizsgálni szeretnénk szálképzett és egyéb módon előállított amorf szilárd diszperziók folyamatos nedves és olvadékos granulálását, illetve folyamatos száraz granulálását (a tablettázási tulajdonságok javítása céljából) és az ezekhez kapcsolódó valós idejű analitikák kidolgozásának lehetőségét.
Saját publikációk
Közvetlenül kapcsolódó saját publikációk listája
[I]: Z. K. Nagy, A. Balogh, B. Démuth, H. Pataki, T. Vigh, B. Szabó, K. Molnár, B. T. Schmidt, P. Horák, G. Verreck, I. Van Assche, M. E. Brewster, Int. J. Pharm., 2015, 480 (1-2), 137–142. oldal
IF: 3,994; Független idéző: 20; Függő idéző: 13
[II]: B. Démuth, Z. K. Nagy, A. Balogh, T. Vigh, G. Marosi, G. Verreck, I. Van Assche, M. E. Brewster, Int. J. Pharm., 2015, 486 (1-2), 268–286. oldal
IF: 3,994; Független idéző: 23; Függő idéző: 3
[III]: B. Démuth, A. Farkas, H. Pataki, A. Balogh, B. Szabó, E. Borbás, P. L. Sóti, T. Vigh, É. Kiserdei, B. Farkas, J. Mensch, G. Verreck, I. Van Assche, G. Marosi, Z. K. Nagy, Int. J. Pharm., 2016, 498 (1-2), 234–244. oldal
IF: 3,649; Független idéző: 5; Függő idéző: 2
[IV]: B. Démuth, A. Farkas, A. Balogh, K. Bartosiewicz, B. Kállai-Szabó, J. Bertels, T. Vigh, J. Mensch, G. Verreck, I. Van Assche, G. Marosi, Z. K. Nagy, J. Pharm. Sci., 2016, 105 (9), 2982–2988. oldal
IF: 2,713; Független idéző: 3; Függő idéző: 1
[V]: T. Vigh, B. Démuth, A. Balogh, D. L. Galata, I. Van Assche, C. Mackie, M. Vialpando, B. Van Hove, P. Psathas, E. Borbás, H. Pataki, P. Boeykens, G. Marosi, G. Verreck, Z. K. Nagy, Drug Dev. Ind. Pharm., 2017, 43 (7), 1126–1133. oldal
IF: 2,295, Független idéző: 1; Függő idéző: 0
[VI]: B. Démuth, A. Farkas, B. Szabó, A. Balogh, B. Nagy, E. Vágó, T. Vigh, A. P. Tinke, Z. Kazsu, Á. Demeter, J. Bertels, J. Mensch, A. Van Dijck, G. Verreck, I. Van Assche, G. Marosi, Z. K. Nagy, Adv. Powder Technol., 2017, 28 (6), 1554–1563. oldal
IF: 2,659; Független idéző: 0; Függő idéző: 0
Közvetetten kapcsolódó publikációk listája
[VII]: A. Balogh, R. Cselkó, B. Démuth, G. Verreck, J. Mensch, G. Marosi, Z. K. Nagy, Int. J. Pharm., 2015, 495 (1), 75–80. oldal
IF: 3,994; Független idéző: 5; Függő hivatkozás: 1
[VIII]: E. Borbás, B. Sinkó, O. Tsinman, K. Tsinman, É. Kiserdei, B. Démuth, A. Balogh, B. Bodák, A. Domokos, G. Dargó, G. T. Balogh, Z. K. Nagy, Mol. Pharm., 2016, 13 (11), 3816–3826. oldal
IF: 4,440; Független idéző: 0; Függő idéző: 0
[IX]: A. Farkas, B. Nagy, B. Démuth, A. Balogh, H. Pataki, Z. K. Nagy, G. Marosi, J. Chemom., 2017, 31 (1), e2861, 1–11. oldal
IF: 1,884;
Független idéző: 0; Függő idéző: 0
[X]: A. Balogh, B. Farkas, Á. Pálvölgyi, A. Domokos, B. Démuth, G. Marosi, Z. K. Nagy, J. Pharm. Sci., 2017, 106 (6), 1634–1643. oldal
IF: 2,713; Független idéző: 0; Függő idéző: 0
Hivatkozások listája
[1]: K. Sekiguchi, N. Obi, Studies on Absorption of Eutectic Mixture. I. A Comparison of the Behavior of Eutectic Mixture of Sulfathiazole and that of Ordinary Sulfathiazole in Man, Chem. Pharm. Bull., 1961, 9 (11) 866–872. oldal
[2]: W. L. Chiou, S. Riegelman, Pharmaceutical applications of solid dispersion systems, Journal of Pharmaceutical Sciences, 1971, 60 (9) 1281–1302. oldal
[3]: A.A. Noyes, W.R. Whitney, Drug Dissolution, J. Am. Chem. Soc., 1897, 19 (12) 930–934. oldal
[4]: Z.K. Nagy, A. Balogh, B. Vajna, A. Farkas, G. Patyi, Á. Kramarics, G. Marosi, Comparison of electrospun and extruded soluplus®-based solid dosage forms of improved dissolution, J. Pharm. Sci., 2012, 101 (1) 322–332. oldal
