 |
BMe Kutatói pályázat |

|
BME Oláh György Doktori Iskola
BME VBK, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Huszthy Péter
Akridin-koronaéter-alapú szenzor- és szelektormolekulák előállítása és vizsgálata
A kutatási téma néhány soros bemutatása
A molekuláris
felismerés koronaéterekkel történő
tanulmányozása nemcsak a jelenség élő szervezetben való működésének mind jobb
megértése szempontjából fontos, hanem azért is, mert az e téren folytatott
kutatások széleskörűen felhasználható szenzor- és szelektormolekulák
kifejlesztéséhez vezethetnek.
A kutatóhely rövid bemutatása
A BME Szerves Kémia és Technológia Tanszékének Szerves Kémia Csoportjában Dr. Huszthy Péter munkásságával kezdődtek meg hazánkban az N-heterociklus egységet tartalmazó koronaéterekkel kapcsolatos kutatások. Kutatócsoportunk heterociklus egységet tartalmazó, illetve könnyen deprotonálható (savanyú protont tartalmazó) akirális és optikailag aktív koronaéterek előállításával, molekuláris felismerőképességük (fémion és enantioszelektivitásuk) tanulmányozásával, valamint szenzor- és szelektormolekulaként történő alkalmazhatóságuk vizsgálatával foglalkozik.
A kutatás történetének, tágabb kontextusának bemutatása
A szenzor- és szelektormolekulák szelektív
komplexképző
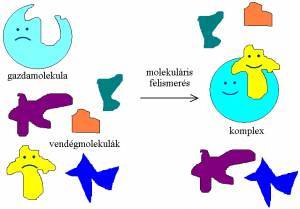 tulajdonságainak
alapja a molekuláris felismerés jelensége, mely során a szenzor, illetve
szelektor gazdamolekula az őt körülvevő molekulahalmazból egy bizonyos típusú
vendégmolekulát kiválaszt, és egy másodlagos
kötőerők által összetartott komplexet alkot vele (1. ábra). A
molekuláris felismerés jelenségére a természetben számtalan példát találhatunk,
melyek közül említhetjük a DNS kettős
csavarjának kialakulását, valamint az enzimek és a receptorok
specifikus működését. Néhány évtizeddel ezelőtt a molekuláris felismerést
kizárólag biológiai jelenségként tartották számon, de a szupramolekuláris
kémia fejlődésével talán egyre hatékonyabban tudjuk utánozni az élő
szervezetek ezen sajátosságát. [1, 2]
tulajdonságainak
alapja a molekuláris felismerés jelensége, mely során a szenzor, illetve
szelektor gazdamolekula az őt körülvevő molekulahalmazból egy bizonyos típusú
vendégmolekulát kiválaszt, és egy másodlagos
kötőerők által összetartott komplexet alkot vele (1. ábra). A
molekuláris felismerés jelenségére a természetben számtalan példát találhatunk,
melyek közül említhetjük a DNS kettős
csavarjának kialakulását, valamint az enzimek és a receptorok
specifikus működését. Néhány évtizeddel ezelőtt a molekuláris felismerést
kizárólag biológiai jelenségként tartották számon, de a szupramolekuláris
kémia fejlődésével talán egyre hatékonyabban tudjuk utánozni az élő
szervezetek ezen sajátosságát. [1, 2]
1. ábra A molekuláris felismerés
A szupramolekuláris kémia egyik úttörője Pedersen, aki egy
melléktermékként izolált ciklikus poliéter (dibenzo-18-korona-6-éter) alkáli- és
alkáliföldfémekkel szembeni szokatlan komplexképző tulajdonságainak megfigyelése
által teremtette meg a koronaéterek kémiájának alapjait. Felismerte, hogy a
koronaéterek üregük méretétől függően eltérő stabilitású komplexeket képeznek
kémiailag hasonló fémionokkal. [3]
A piridin egységet tartalmazó koronaéterek az aromás gyűrűnek és a lágy nitrogén atomnak köszönhetően kivételes komplexálási képességet tanúsítanak nehézfémionokkal és protonált primer aminokkal szemben. [4, 5, 6] Optikailag aktív piridin-koronaéterek királis protonált primer aminokkal alkotott komplexeinek tanulmányozása során azt találták, hogy a gazda- és vendégmolekula közötti kölcsönhatásban három független tényező a legfontosabb: a három pontos hidrogénkötés a makrogyűrű heteroatomjai és az ammóniumsó protonjai között, a π–π kölcsönhatás az elektronhiányos piridingyűrű és a vendégmolekula elektrondús aromás része között, valamint a sztérikus gátlás a ligandum aszimmetriacentrumain található szubsztituensek és az ammóniumsó aromás hidrogénjei között.
Az akridin egység piridinnél
kiterjedtebb aromás rendszere nemcsak a π–π kölcsönhatás növelésében
játszhat szerepet, hanem a makrogyűrűt merevebbé téve a szelektivitást is
növeli; emellett fluoro- és kromogén, tehát komplexképzése az érzékeny
fotofizikai módszerekkel, pl. fluoreszcencia-spektroszkópiával is
tanulmányozható.
A kutatás célja, a megválaszolandó kérdések
Napjainkban széleskörű tudományos érdeklődés
irányul a különböző fémionok, szerves ionos és semleges molekulák, illetve
királis vegyületek enantiomerjeinek egyre
szelektívebb felismerését biztosító szenzormolekulák, valamint az ezek
elválasztását is lehetővé tevő szelektormolekulák kifejlesztésére.
Alkalmazásukra az orvosi kémiában, a gyógyszeriparban, az élelmiszeriparban, a
környezetvédelemben, a kozmetikai iparban, a növényvédőszer-iparban és a
tudományos élet számos egyéb területén is igény merül fel.
Munkánk célja új, akridin heterociklus egységet
tartalmazó 18-korona-6 éter típusú, akirális és enantiomertiszta szenzor- és
szelektormolekulák előállítása volt. A potenciálisan fémion-, valamint
enantiomerfelismerésre képes ligandumok komplexképzési tulajdonságait
potenciometriás, fluoreszcenciás, illetve egyéb módszerekkel is tanulmányoztuk.
[7, 8, 9, 10]
Módszerek
A vegyületek előállítását a modern preparatív szerves kémia módszereivel végeztük. Az anyagok tisztaságának ellenőrzésére vékonyréteg-kromatográfiát, olvadáspontmérést, illetve optikai forgatóképesség-mérést használtunk. Az előállított vegyületek szerkezetét IR, 1H- és 13C-NMR, tömegspektroszkópiai, elemi analízis, valamint ESR módszerekkel igazoltuk.
A vegyületek fémion- és enantioszelektivitását potenciometriás, fluoreszcenciás, kevertetéses és kromatográfiás módszerekkel vizsgáltuk.
A potenciometria
olyan elektroanalitikai eljárás, mely során a mérendő komponens meghatározása a
vizsgálandó oldatban elhelyezett ún. mérőelektródon (pl. ionoforalapú,
lágyított polimermátrixra épülő ionszelektív
elektródon) kialakuló potenciáljel, az elektródpotenciál mérése alapján
történik. Mivel az elektródpotenciált önmagában nem lehet mérni, ezért a
vizsgálandó oldatot, a mérőelektródot és valamilyen állandó potenciálú ún.
referenciaelektródot tartalmazó elektrokémiai mérőcella elektromotoros erejét
mérjük. [11, 12]
Az optikai szenzorok esetében a minta egy adott komponense és a szenzor között létrejövő kémiai kölcsönhatás nyomonkövetése optikai jelenségek, például a fluoreszcencia mérése alapján történik,[13, 14] Fluoreszcencia alatt azt a jelenséget értjük, amikor egy molekula elektronja ultraibolya vagy látható fénysugárzás hatására gerjesztődik (azaz egy foton energiáját elnyelve – abszorbeálva – magasabb energiájú állapotba kerül), majd az elnyelt energiát az elnyelttel azonos vagy nagyobb hullámhosszú (kisebb energiájú) fény formájában kisugározva visszakerül az alapállapotába. A fluoreszcenciaspektrum felvétele során a mintát adott hullámhosszúságú fénnyel besugározva a kibocsátott fény intenzitását mérjük a hullámhossz függvényében.
A molekuláris felismerés céljából alkalmazott
ligandumok immobilizálása egyesíti a makrociklus szelektivitását és a szilárd
fázis könnyű visszanyerhetőségét, újrafelhasználhatóságát. A ligandumok
előállítása drága és hosszadalmas, valamint biológiai rendszerekben felhasználva
toxikus is lehet, így a ligandumok csekély vesztesége is elkerülendő, amit
immobilizálással, például szilikagélhez rögzítéssel biztosíthatunk. Az
immobilizált makrociklusok komplexképzése vizsgálható kevertetéses
módszerrel (amikor az immobilizált ligandumot a komplex-egyensúly beálltáig a
vendégmolekulák oldatával kevertetjük, majd a komplexképződés mértékét
vizsgáljuk), illetve kromatográfiásan
(mikor az immobilizált ligandummal töltött kromatográfiás oszlopon választjuk el
a vendégmolekulákat).
Eddigi eredmények
Doktori munkám célja volt különböző feladatokra
alkalmas, akridin egységet tartalmazó 18-korona-6 éter típusú szenzor- és
szelektormolekulák szintézise és molekuláris felismerőképességük többféle
módszerrel történő vizsgálata. Dolgozatomban huszonegy új vegyület – köztük hét
enantiomertiszta és tizennégy akirális – és négy ismert vegyület új eljárással
történő előállítása szerepel. [7, 8, 9, 10]
Protonált primer aminokkal és amminosavészter-sókkal történő enantioszelektív komplexképzés, valamint fémion-szelektivitásuk tanulmányozása céljából állítottuk elő a 2. ábrán szereplő enantiomertiszta (R,R)-1–(S,S)-4 akridin-18-korona-6-étereket.
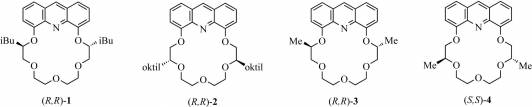
2. ábra Az előállított enantiomertiszta akridin-18-korona-6-éterek
Az (R,R)-1, izobutilcsoportokat
az aromás gyűrűhöz közelebb, és (R,R)-2, oktilcsoportokat az
aromás gyűrűtől távolabb tartalmazó akridin-koronaéterek enantio- és
fémion-szelektivitását potenciometriás módszerrel vizsgáltuk. Azt találtuk, hogy
a kiralitáscentrum aromás gyűrűtől való távolságának nagy hatása van az
enantioszelektivitás mértékére: az (R,R)-1 koronaéter jelentős
enantioszelektivitást mutatott az S-feniletilammónium ionnal szemben
(ΔlogK=0,25), míg az (R,R)-2 koronaéter csekély
enantioszelektivitással rendelkezik. Emellett (R,R)-2 koronaéter
esetén, kiemelkedő szelektivitást tapasztaltunk Ag(I) ionra a vizsgált
alkálifém-, alkáliföldfém- és nehézfémionokkal szemben. Külön említésre méltó,
hogy bár az ismert Ag(I) szelektív elektródok esetén a Hg(II) és a Cu(II) erős
interferenciát szokott okozni, a mi esetünkben (R,R)-2 Ag(I)-re
ezek ellenében is kiváló szelektivitással bír (ΔlogK≥4,5). [7]
Az (R,R)-1 izobutilcsoportokat és
(R,R)-3 metilcsoportokat az aromás gyűrűhöz közelebb, valamint
(S,S)-4 metilcsoportokat az aromás gyűrűtől távolabb tartalmazó
akridin-koronaéterek 1-feniletilamin, 1-(naft-1-il)-etilamin,
fenilglicin-metilészter és fenilalanin-metilészter hidrogénperklorát sóival
szemben mutatott enantioszelektivitását fluoreszcenciás módszerrel
tanulmányoztuk. Az előző, potenciometriás tapasztalatainkkal összhangban, ez
esetben is tapasztaltuk, hogy az alkilcsoportok térkitöltése és a makrogyűrűben
elfoglalt helyzete jelentős hatással van az enantiomerfelismerés mértékére. A
mért sók közül a legnagyobb enantioszelektivitást az (R,R)-3
koronaéterrel, 1-(naft-1-il)-etilammóniumion enantiomerjeivel szemben találtuk
(ΔlogK=0,41). [8]
A makrogyűrűben szekunder-amino-csoportot
tartalmazó 5 és 6 makrociklusok lehetőséget nyújtanak arra, hogy
ezeket alkilezve új szenzor- (7–10) és szelektormolekulát
(SP-11) állíthassunk elő (3. ábra).
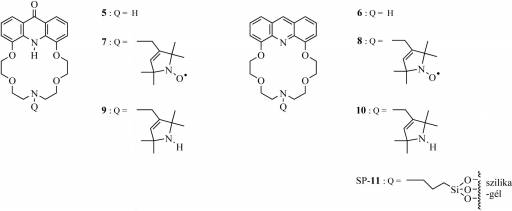
3.
ábra A makrogyűrűben nitrogénatomot tartalmazó
makrociklusok
A kettősen jelölő vegyületek (amelyek fluorofor és
szabadgyök részt is tartalmaznak, így fluoreszcencia és ESR
spektroszkópiával is vizsgálhatóak) esetében a fluoreszcenciakioltás
mechanizmusa még nem tisztázott pontosan, így fontos ezek előállítása és
vizsgálata. [15] A 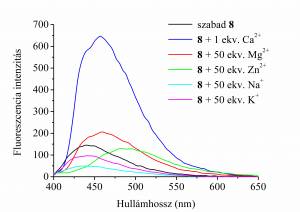 szakirodalomban
korábban még nem szerepelt olyan makrociklus, amely egy molekulán belül tartalmaz
fluorofor, szabadgyök és koronaéter részt. Ilyen a spinjelzett 7 akridon
és 8 akridin egységet tartalmazó makrociklus.
szakirodalomban
korábban még nem szerepelt olyan makrociklus, amely egy molekulán belül tartalmaz
fluorofor, szabadgyök és koronaéter részt. Ilyen a spinjelzett 7 akridon
és 8 akridin egységet tartalmazó makrociklus.
A kettősen jelölő 7 és 8 koronaétereknek, valamint ezek diamágneses 9 és 10 származékainak a fémion-szelektivitását néhány biológiailag fontos fémionnal [Na(I), K(I), Ca(II), Mg(II), Zn(II)] szemben fluoreszcenciásan vizsgáltuk. [10] Azt tapasztaltuk, hogy a spinjelölés fluoreszcenciakioltást okoz. Az akridin-koronaéterek Ca(II) és Zn(II) ionokkal nagy stabilitású komplexeket képeztek (logK≈6,7), és 8 koronaéter mutatta Ca(II) hozzáadására a legnagyobb fluoreszcenciaintenzitás-növekedést (4. ábra).
4. ábra A kettősen jelölő 8 ligandum Ca(II)-ra
mutatott jelentős
intenzitásnövekedése
Az SP-11 szilikagélhez kötött makrociklust
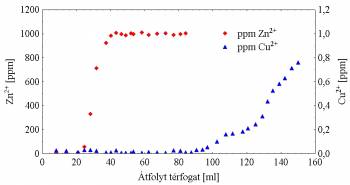 biológiailag
fontos fémionok elválaszthatóságának tanulmányozása céljából kevertetéses
módszerrel vizsgáltuk. Az SP-11 állófázis a vizsgált fémionok közül
Ag(I), Cu(II) és Hg(II) ionokkal képezte a legerősebb komplexeket (logK≈2,0),
míg a többi ionnal egy-két nagyságrenddel gyengébbet. Előkísérleteket is
végeztünk kromatográfiás oszlopon arra vonatkozóan, hogy képes-e híg vizes oldatból
fémionokat eltávolítani. Meg tudtuk valósítani a 10 ppm mennyiségben jelenlevő
Cu(II) kivonását a 100-szoros mennyiségben jelenlévő Zn(II) mellől vizes oldatban
(5. ábra). [9]
biológiailag
fontos fémionok elválaszthatóságának tanulmányozása céljából kevertetéses
módszerrel vizsgáltuk. Az SP-11 állófázis a vizsgált fémionok közül
Ag(I), Cu(II) és Hg(II) ionokkal képezte a legerősebb komplexeket (logK≈2,0),
míg a többi ionnal egy-két nagyságrenddel gyengébbet. Előkísérleteket is
végeztünk kromatográfiás oszlopon arra vonatkozóan, hogy képes-e híg vizes oldatból
fémionokat eltávolítani. Meg tudtuk valósítani a 10 ppm mennyiségben jelenlevő
Cu(II) kivonását a 100-szoros mennyiségben jelenlévő Zn(II) mellől vizes oldatban
(5. ábra). [9]
5. ábra Az SP-11 állófázissal végzett
kromatográfiás előkísérlet
Várható impakt, további kutatás
Doktori munkám során akridin heterociklus egységet tartalmazó, 18-korona-6 éter-alapú, akirális és enantiomertiszta, szenzor- és szelektormolekulákat állítottunk elő, melyeknek a fémion- és enantiomerfelismerését potenciometriás, fluoreszcenciás, kevertetéses és kromatográfiás módszerekkel tanulmányoztuk. Eredményeinket a Tetrahedron és a Tetrahedron:Asymmetry nemzetközi folyóiratokban publikáltuk.
A továbbiakban szeretnénk a kiralitáscentrumokon
eddig nem említett oldalláncokat tartalmazó akridin-koronaéterek, illetve más
(pl. fentiazin) heterociklus egységet tartalmazó koronaéterek szintézisét,
valamint fémion- és enantioszelektivitásukra irányuló vizsgálatukat
megvalósítani.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája
-
Kertész, J., Huszthy, P., Kormos, A., Bertha, F., Horváth, V., Horvai, G., Tetrahedron: Asymm. 2009, 20, 2795–2801.
-
Kertész, J., Móczár, I., Kormos, A., Baranyai, P., Kubinyi, M., Tóth, K., Huszthy, P., Tetrahedron: Asymm. 2011, 22, 684–689.
-
Kertész, J., Huszthy, P., Kormos, A., Bezúr, L., Tetrahedron 2011, 67, 5206–5212.
-
Kertész, J., Bognár, B., Kormos, A., Móczár, I., Baranyai, P., Kubinyi, M., Kálai, T., Hideg, K., Huszthy, P., Tetrahedron, 2011, doi:10.1016/j.tet.2011.09.092
Hivatkozások listája
[1] Atwood, J. L.,Steed, J. W., Encyclopedia of Supramolecular Chemistry 2004, Marcel Dekker: New York, NY
[2] Steed, J. W., Atwood, J. L., Supramolecular Chemistry 2009, Wiley, 2. kiadás.
[3] Pedersen, C. J., J. Am. Chem. Soc. 1967, 89, 2495–2496.
[4] Izatt, R. M., Pawlak, K., Bradshaw, J. S., Bruening, R. L., Chem. Rev. 1991, 91, 1721–2085.
[5] Izatt, R. M.; Pawlak, K.; Bradshaw, J. S. Chem. Rev. 1995, 95, 2529–2586.
[6] Zhang, X. X.; Bradshaw, J. S.; Izatt, R. M. Chem. Rev. 1997, 97, 3313–3361.
[7] Kertész, J., Huszthy, P., Kormos, A., Bertha, F., Horváth, V., Horvai, G., Tetrahedron: Asymm. 2009, 20, 2795–2801.
[8] Kertész, J., Móczár, I., Kormos, A., Baranyai, P., Kubinyi, M., Tóth, K., Huszthy, P., Tetrahedron: Asymm. 2011, 22, 684–689.
[9] Kertész, J., Huszthy, P., Kormos, A., Bezúr, L., Tetrahedron 2011, 67, 5206–5212.
[10] Kertész, J., Bognár, B., Kormos, A.,
Móczár, I., Baranyai, P., Kubinyi, M., Kálai, T., Hideg, K., Huszthy, P., Tetrahedron 2011,
doi:10.1016/j.tet.2011.09.092
[11] Morf, W. E., The Principles of
Ion-Selective Electrodes and of Membrane Transport; Elsevier: New York,
1981, 264–336.
[12] Koryta, J., Štulík, K., Ion-selective
Electrodes, 2. kiadás, Cambridge University Press, Cambridge, 1983,
168–194.
[13] Valeur, B., Molecular Fluorescence:
Principles and Applications; Wiley-VCH: Weinheim, Németország, 2002.
[14] Lakowicz, J. R., Principles of Fluorescence Spectroscopy, 3. kiadás, Springer Science+Business Media: New York, NY, 2006.
[15] Kálai, T., MTA Doktori értekezés
2007.

