|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Kupai József
Természetes vegyületek alkalmazása szerves kémiában
A kutatási téma néhány soros bemutatása
Számos esetben tapasztalhatjuk, hogy a vegyészek a természetes vegyületekből inspirálódva állítanak elő új molekulákat, melyeket a gyógyszeripartól kezdve a katalízisig széleskörűen alkalmazhatnak. Munkám során ezeket a természetből izolálható molekulákat felhasználva új királis organokatalizátorokat, valamint egy oldószert állítottam elő, melyet különböző katalitikus reakciókban alkalmaztam.
A kutatóhely rövid bemutatása
Az Organokatalízis Kutatócsoportban a modern vegyiparhoz elengedhetetlennek tartjuk az új katalitikus eljárások kidolgozását. A katalizátorok segítségével energiát takaríthatunk meg, és jelentősen növelhetjük a reakciók szelektivitását. Legfőbb kutatási területünk közé tartozik az organokatalizátorok alkalmazása és visszaforgatása aszimmetrikus szintézisekben és polimerbontási reakciókban, illetve különböző természetes vegyületeknek az átalakítása és értéknövelt alkalmazása.
A kutatás történetének, tágabb kontextusának bemutatása
A természetes vegyületek napjainkban egyre nagyobb szerepet töltenek be. A növények képesek a fotoszintézis során a levegőben található szén-dioxidot felhasználni, és sok bonyolult, akár több aszimmetrikus centrummal rendelkező molekulákat előállítani. Ezek a királis molekulák az úgynevezett királis készlet (chiral pool) részei, melyek előállítása többlépéses, sztereoszelektív totálszintézissel valósítható meg, komoly kihívás elé állítva a szerves kémikusokat. Ezért célszerű ezeket a vegyületeket közvetlenül biológiai forrásból, különösen hulladékokból (pl. a fáknak a kérgéből) izolálni és kiindulási anyagként felhasználni. Munkámban királis organokatalizátorokat alkalmaztam. Ezek olyan kisméretű, fémet nem tartalmazó szerves molekulák, amelyek különböző funkciós csoportjaik révén elősegítik a szerves kémiai átalakulásokat. A téma fontosságát szemlélteti, hogy 2021-ben David MacMillan és Benjamin List kémiai Nobel-díjat kaptak az aszimmetrikus organokatalízis kidolgozásáért. Az aszimmetrikus organokatalizátorok előnye, hogy képesek befolyásolni a keletkező molekulák kiralitását. A királis vegyületek olyan molekulák, amelyek nem hozhatók fedésbe egymással, tehát egymás tükörképei, akárcsak a két kezünk. A biológiai rendszerekben ez igen fontos, hiszen attól függően, hogy melyik tükörképi párt alkalmazzuk, szignifikánsan eltérő hatást tapasztalhatunk. Erre jó példa az aszpartám édesítő, melynek egyik tükörképi párja édes, míg a másik íztelen. Az organokatalizátorok „csodája” pontosan ebben rejlik, hiszen megfelelő körülmények között szelektíven csak az egyik tükörképi pár keletkezik segítségükkel.
A kutatás célja, a megválaszolandó kérdések.
Kutatásom során célul tűztem ki új királis organokatalizátorok előállítását. Az organokatalizátorok királis egységeként egy természetes aminosavat, az (S)-prolint, valamint Dél-Amerikában őshonos kínafa kérgéből izolálható cinkona alkaloidokat alkalmaztam. Az előállított organokatalizátorokat olyan gyógyszeripari szempontból releváns aszimmetrikus szintézisekben vizsgáltam, mint például a Michael-addíció, és Diels–Alder-reakció. Mivel az organokatalizátorok előállítása gyakran hosszú és költséges folyamat, ezért további célom volt egy cinkonaalkaloid-alapú organokatalizátor visszaforgatása lipofil oldallánc beépítésének segítségével. A katalizátor visszaforgatását a simaizom-görcsoldó hatással rendelkező baclofen gyógyszerhatóanyag előállítása során vizsgáltam. Doktori munkámban szeretném kiterjeszteni az előállított organokatalizátorok alkalmazását minél szélesebb körre, valamint feltárni az alkalmazásuk korlátait.
Ezenfelül munkámban célom volt az alternatív oldószerek palettájának a bővítése is. Egy új oldószer előállításához kiindulási vegyületként a szezámmagból is izolálható szezamolt választottam, amelynek hidroxilcsoportjának metilezésével állítottam elő a szobahőmérsékleten színtelen folyadékot, a metilszezamolt (MeSzezamol). A MeSzezamolt oldószerként alkalmaztam a korábban említett aszimmetrikus organokatalitikus reakciókban, valamint a jó oldhatósági karakterének köszönhetően kiterjesztettem alkalmazását polimerkémiai reakciókra is.
Módszerek
A vegyületek előállítása során preparatív szerves kémiai módszereket alkalmaztam. A reakciókat vékonyréteg-kromatográfiával (VRK), valamint nagyhatékonyságú folyadékkromatográfia-tömegspektrometria (HPLC-MS) mérésekkel követtem. Az előállított anyagokat preparatív vékonyréteg-kromatográfiásan, átkristályosítással, valamint oszlopkromatográfiásan tisztítottam. Az előállított vegyületek szerkezetét és tisztaságát mágneses magrezonancia spektroszkópiával (1H-, 13C-NMR), infravörös spektroszkópiával (IR), optikai forgatóképesség mérésével, illetve nagy felbontású tömegspektrometriával (HRMS) azonosítottam. Az aszimmetrikus reakciók során a termékek enantiomertisztaságát királis HPLC segítségével határoztam meg. A királis HPLC technika alapvető eleme a királis oszlop, melyben egy királis állófázis (pl. cellulóz) található. Ezen az oszlopon nagy (akár 200–300 bar) nyomás segítségével áramoltatjuk az elválasztandó komponensek oldatát. Mivel a királis molekula két tükörképi párja (enantiomere) különböző erősségű kölcsönhatásokat alakítanak ki az oszlop állófázisával, ezért különböző sebességgel haladnak át az oszlopon. Ennek következtében az enantiomerek elválnak egymástól, ami lehetővé teszi a két enantiomer arányának a pontos meghatározását. A MeSzezamol termikus tulajdonságait differenciális pásztázó kalorimetria (DSC) és termogravimetriás analízis (TGA) segítségével határoztuk meg, míg a nyílt téri lobbanáspont meghatározása Marcusson-féle készülékkel történt.
Eddigi eredmények
Királis organokatalizátorok előállítása
Munkám során (S)-prolin aminosavból, valamint kininből kiindulva állítottam elő királis organokatalizátorokat. Hogy az organokatalizátorok alkalmazását hatékonyabbá tegyem, előállítottam egy lipofil katalizátort is, amely szerkezetéből adódóan poláris oldószerekben nagyon alacsony oldhatósággal rendelkezik, ezáltal egyszerű szűréssel visszaforgatható (1. ábra).
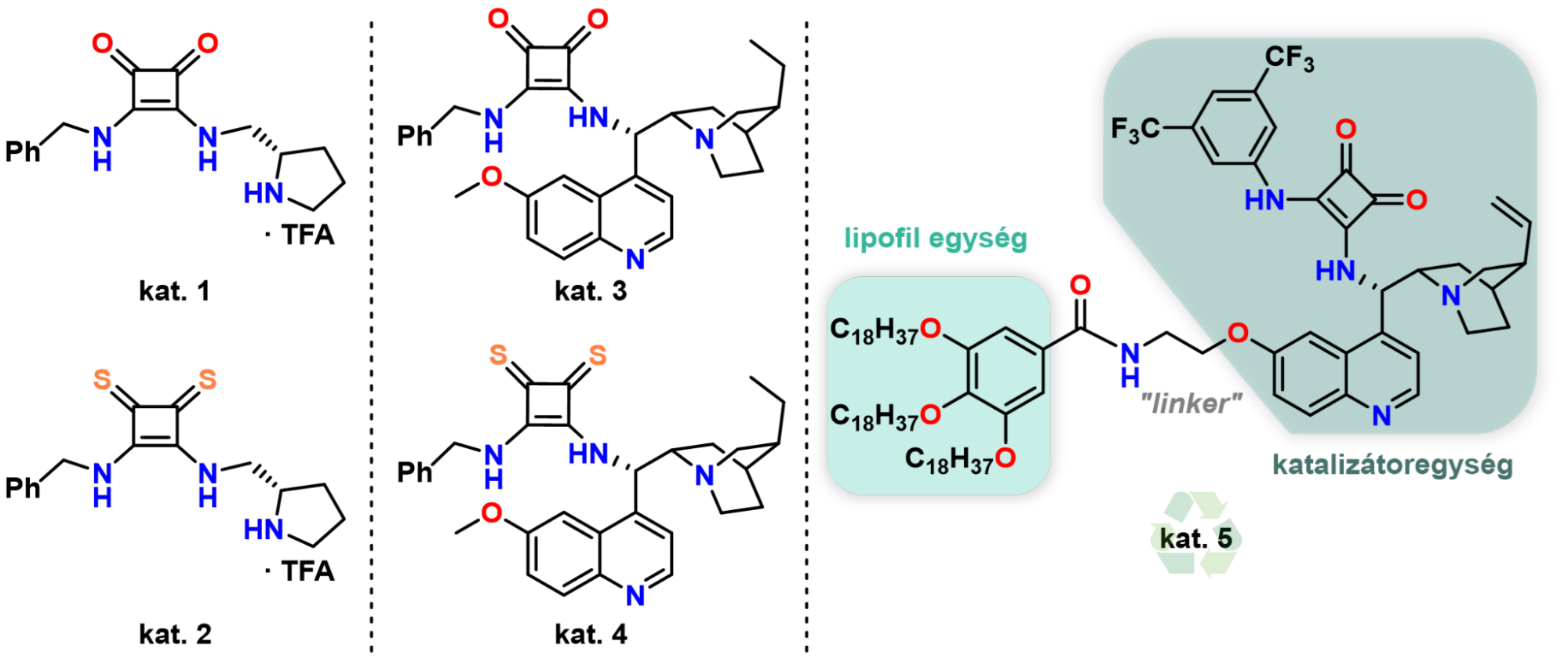
1. ábra Királis prolin- és cinkonaalapú organokatalizátorok
Organokatalizátorok alkalmazása
Az organokatalizátorokat aszimmetrikus szintézisekben alkalmaztam. Ezek a reakciók rendkívüli fontosak a gyógyszeriparban, mivel segítségükkel elérhető, hogy egy adott királis molekula két tükörképe közül csak az egyik keletkezzen. Egy-egy katalizátor szelektivitásának a hatékonyságát az enantiomerfelesleggel szokás jellemezni. Minél magasabb ez az érték, annál nagyobb a szelektivitás. A prolinalapú organokatalizátorokat Diels–Alder-reakciókban vizsgáltam, amely segítségével bonyolult gyűrűrendszereket lehet kialakítani (2. ábra).
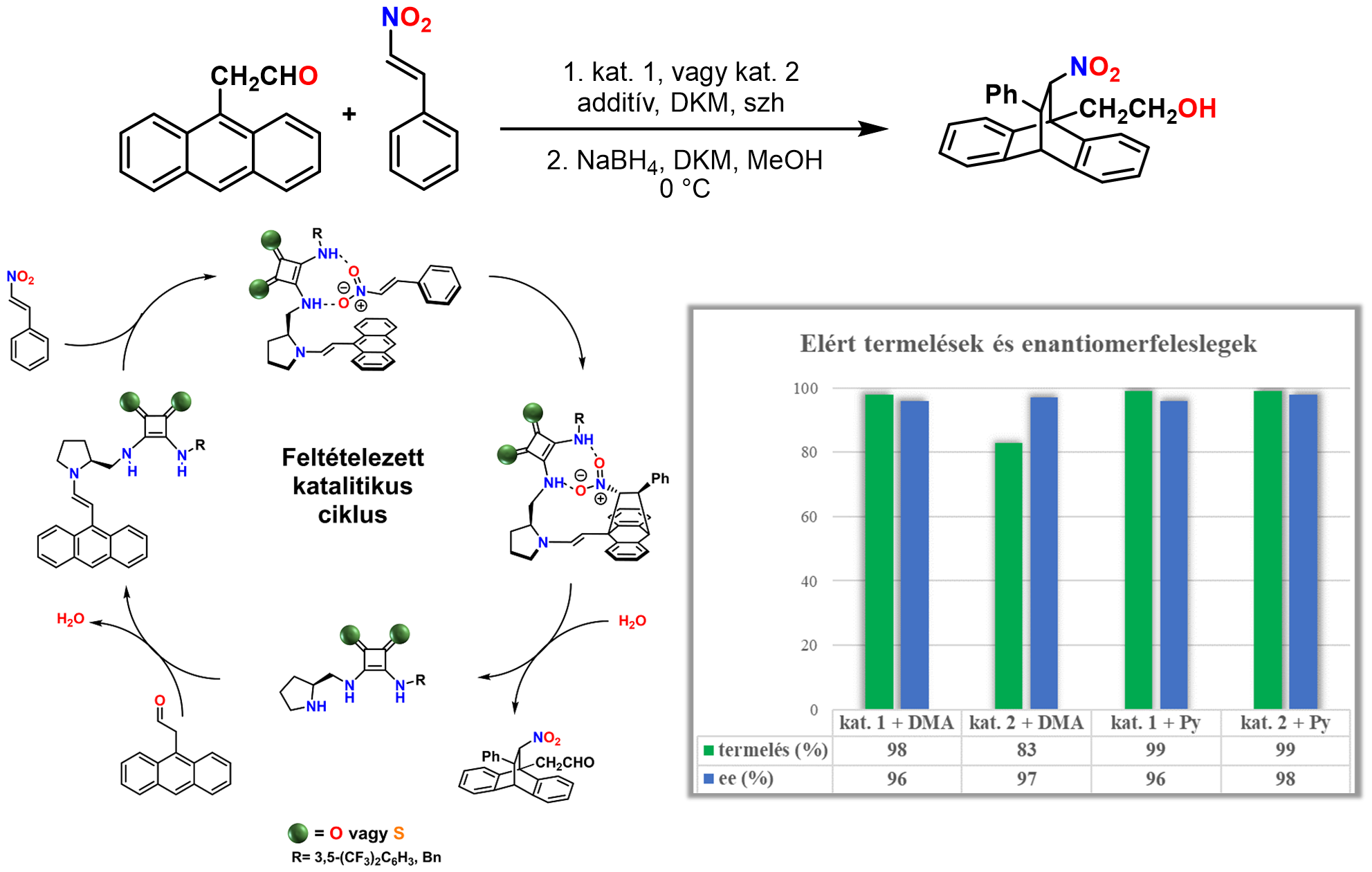
2. ábra Prolinalapú organokatalizátorok alkalmazása Diels–Alder-reakcióban
Ezenfelül vizsgáltam az előállított lipofil organokatalizátor visszaforgatását a baclofen gyógyszerhatóanyag előállítása során. A reakciót követően eltávolítottam az apoláris oldószert (anizol vagy toluol), majd egy poláris oldószert (acetonitril) adtam hozzá. Mivel a poláris oldószer nem oldja a lipofil organokatalizátort, viszont a keletkező terméket oldja, ezért a kivált katalizátor egyszerű centrifugálással elválasztható és új katalitikus ciklusban felhasználható (3. ábra).
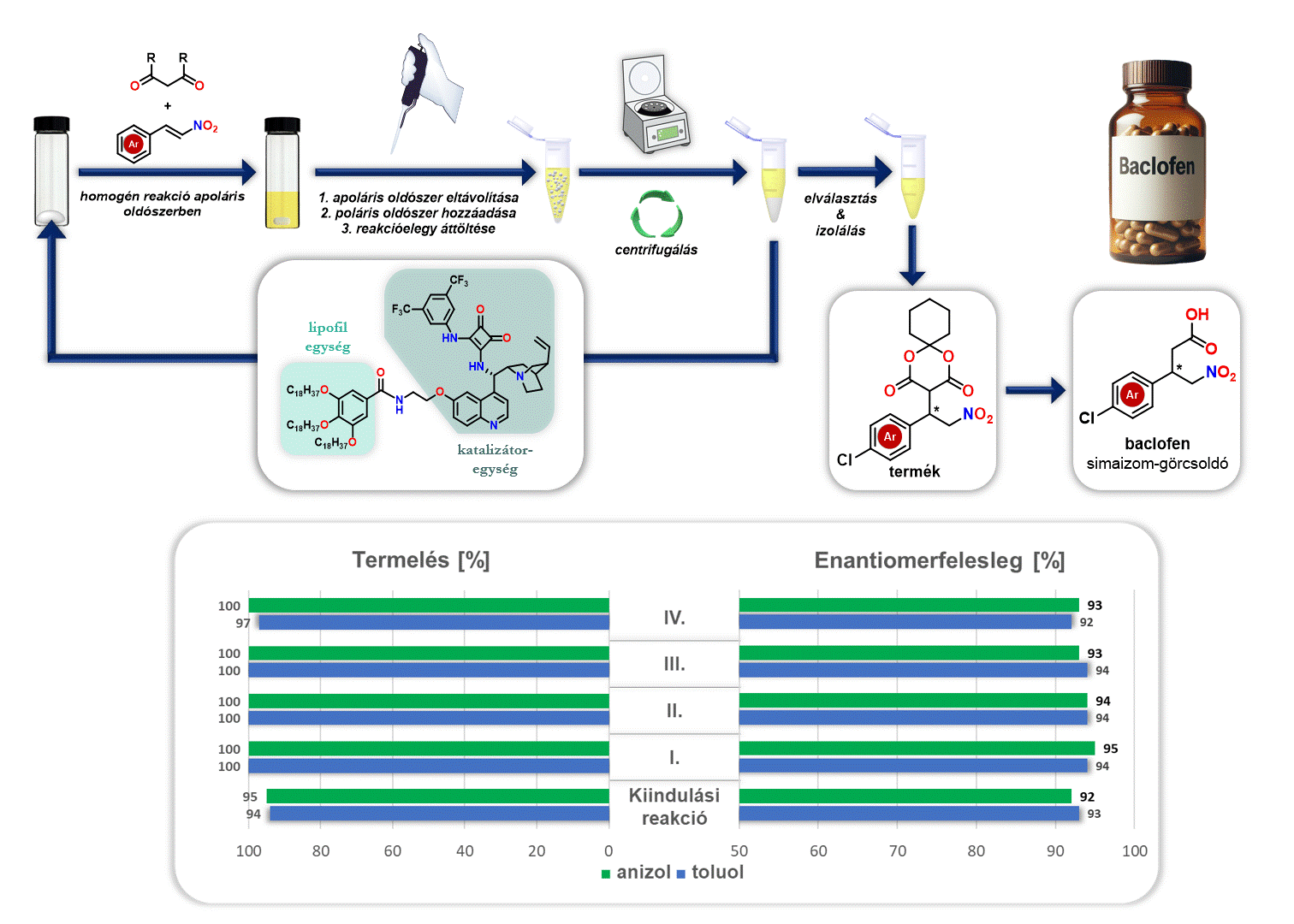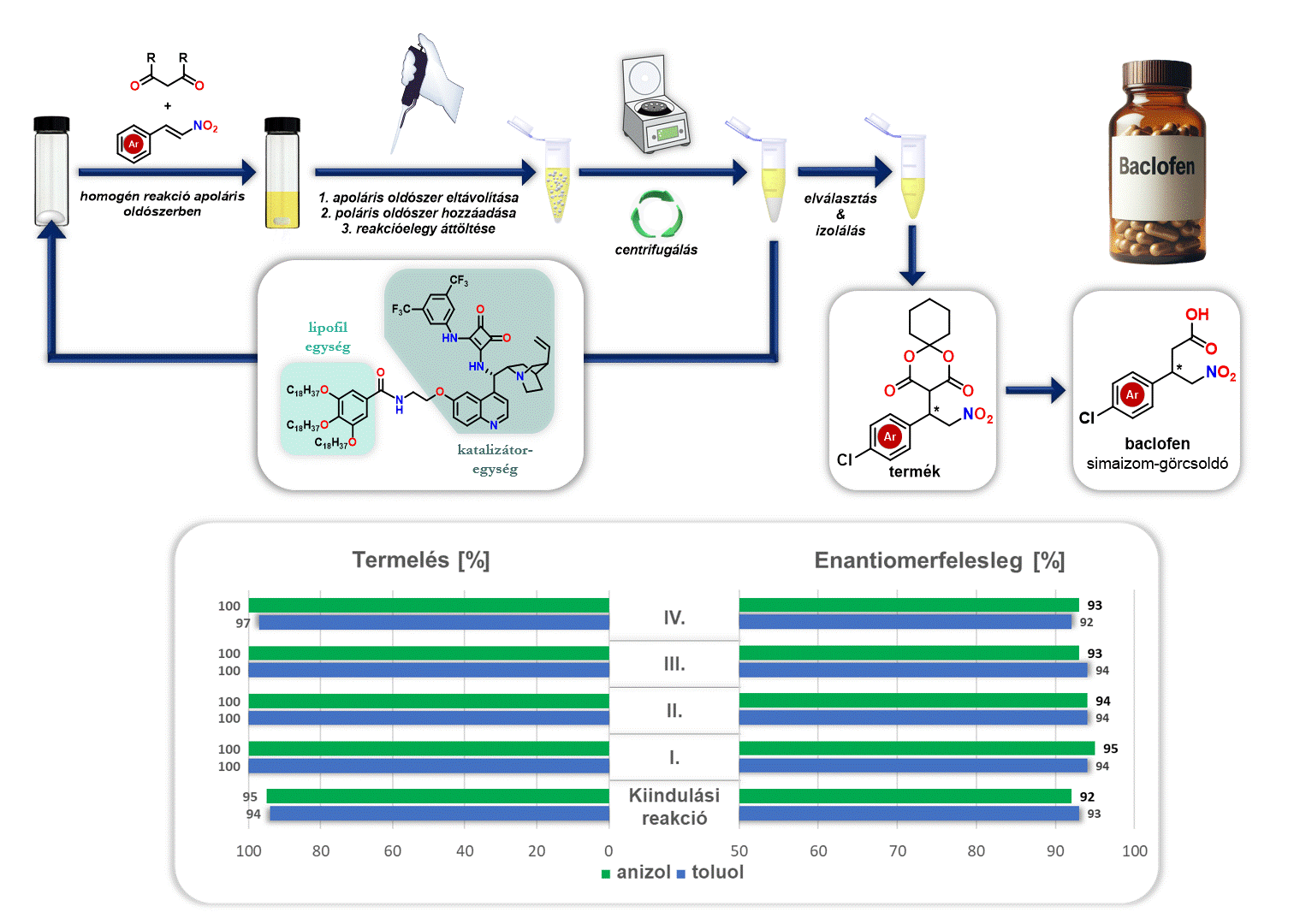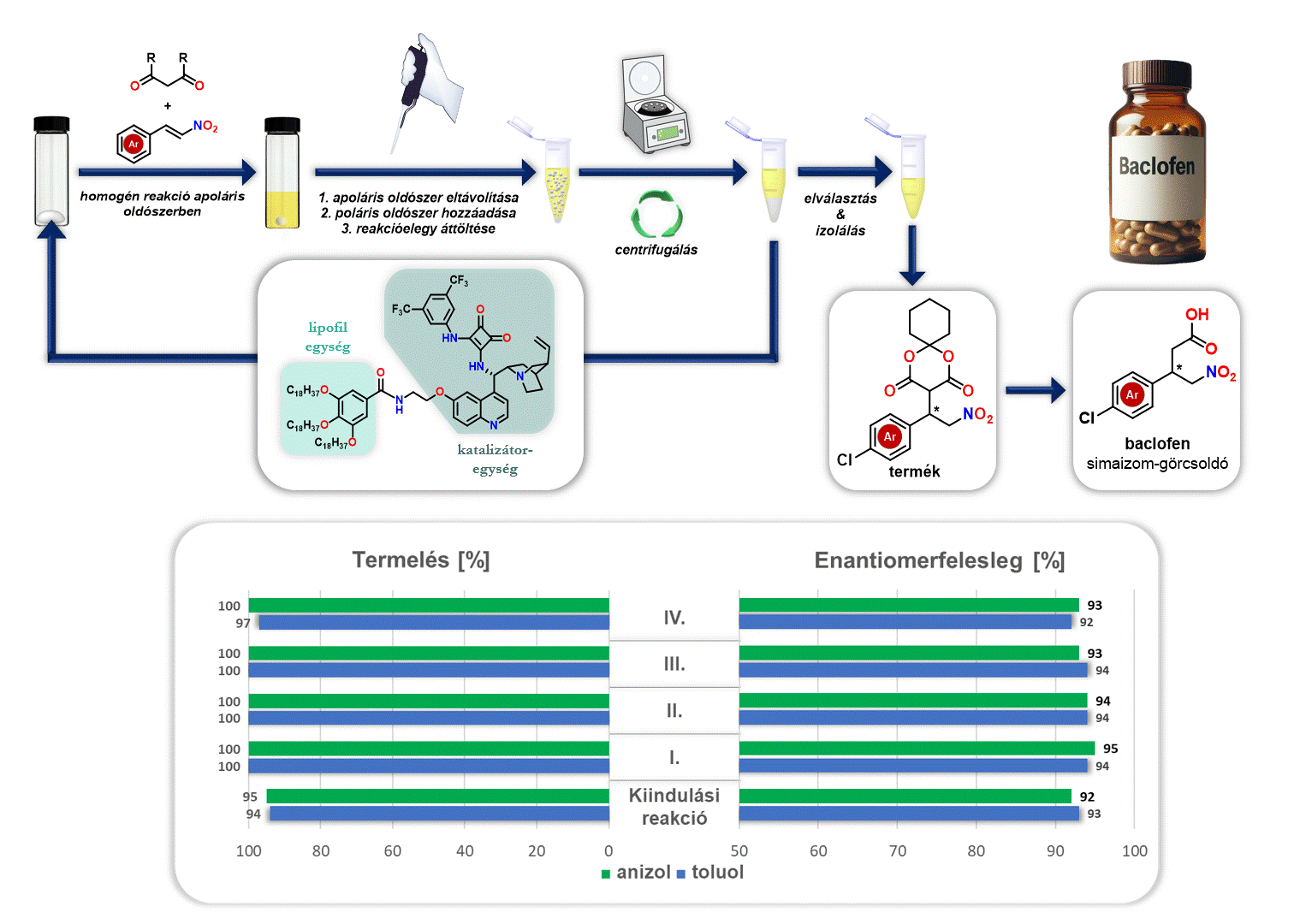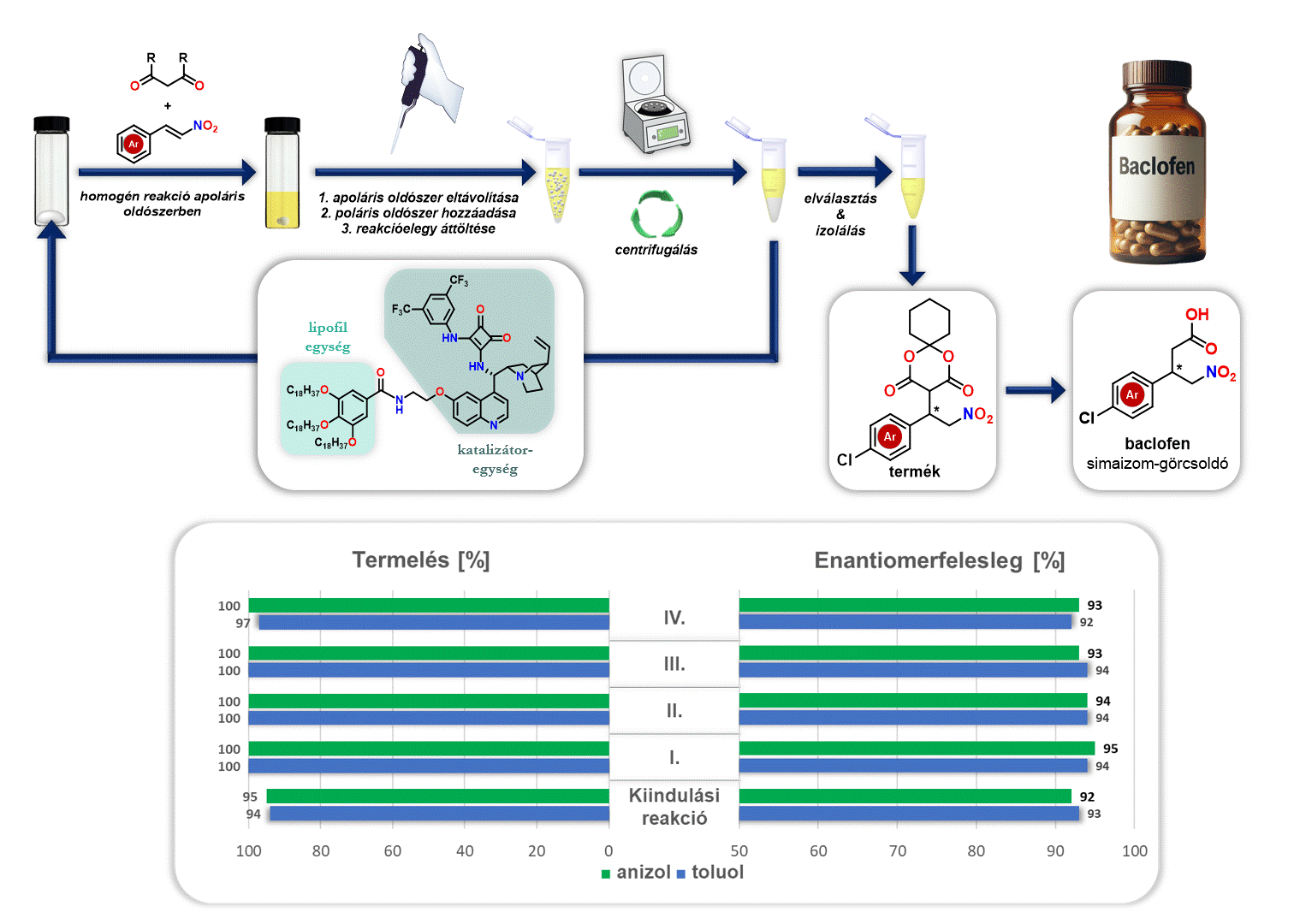
3. ábra Lipofil organokatalizátor visszaforgatása baclofen szintézise során
Ezek alapján jól látható a prolin-származékok és cinkona alkaloidok katalízisben betöltött szerepe. A cinkona alkaloidok közismerten rendelkeznek biológiai aktivitással. Legismertebb képviselőjük a kinin hosszú ideig a malária kezelésére használt gyógyszerként szolgált. Vizsgálataink alapján az általunk előállított cinkona organokatalizátorok is rendelkeznek biológiai aktivitással, tehát alkalmazásuk jövőben nem csak a katalízis, hanem gyógyászat terén is nagy potenciált rejthet magában.
MeSzezamol: egy új, természetes alapú oldószer
A fosszilis energiahordozók korlátozott hozzáférhetősége és környezeti problémái miatt az emberiség egyik legnagyobb kihívása ezek megújuló alapanyagokkal történő kiváltása. Ez a törekvés megfigyelhető az oldószerek esetén is, amelyek a vegyiparban keletkező hulladékok egyik legjelentősebb részét teszik ki. Munkám során MeSzezamolt állítottam elő, amely a poláris aprotikus oldószereknek egy új ígéretes, természetes alternatívája lehet. A MeSzezamol előnyös tulajdonságokkal rendelkezik, hiszen nem illékony, a forráspontja (229–230 °C), és a nyílttéri lobbanáspontja (123 °C) is magas; vízzel nem, de hagyományos szerves oldószerekkel elegyedik. A MeSzezamolt sikeresen alkalmaztuk oldószerként különböző szén-szén kapcsolási reakciókban, mint például Suzuki-, és Sonogashira-reakciókban, valamint aszimmetrikus Michael-addíciókban.
Továbbá kiváló oldószernek bizonyult a MeSzezamol a poli(biszfenol-A-karbonát) [BPA-PC], valamint a poli(etilén-tereftalát) [PET] depolimerizációjában. A MeSzezamol kitűnő oldhatósági tulajdonságának köszönhetően lehetővé tette ezeknek a műanyagoknak az irodalomban egyik legalacsonyabb hőmérsékleten történő lebontását monomerekre. Továbbá a MeSzezamol előnye, hogy a depolimerizáció során a reakciót követően egyszerű fázisszeparációval könnyen visszaforgatható volt (4. ábra).
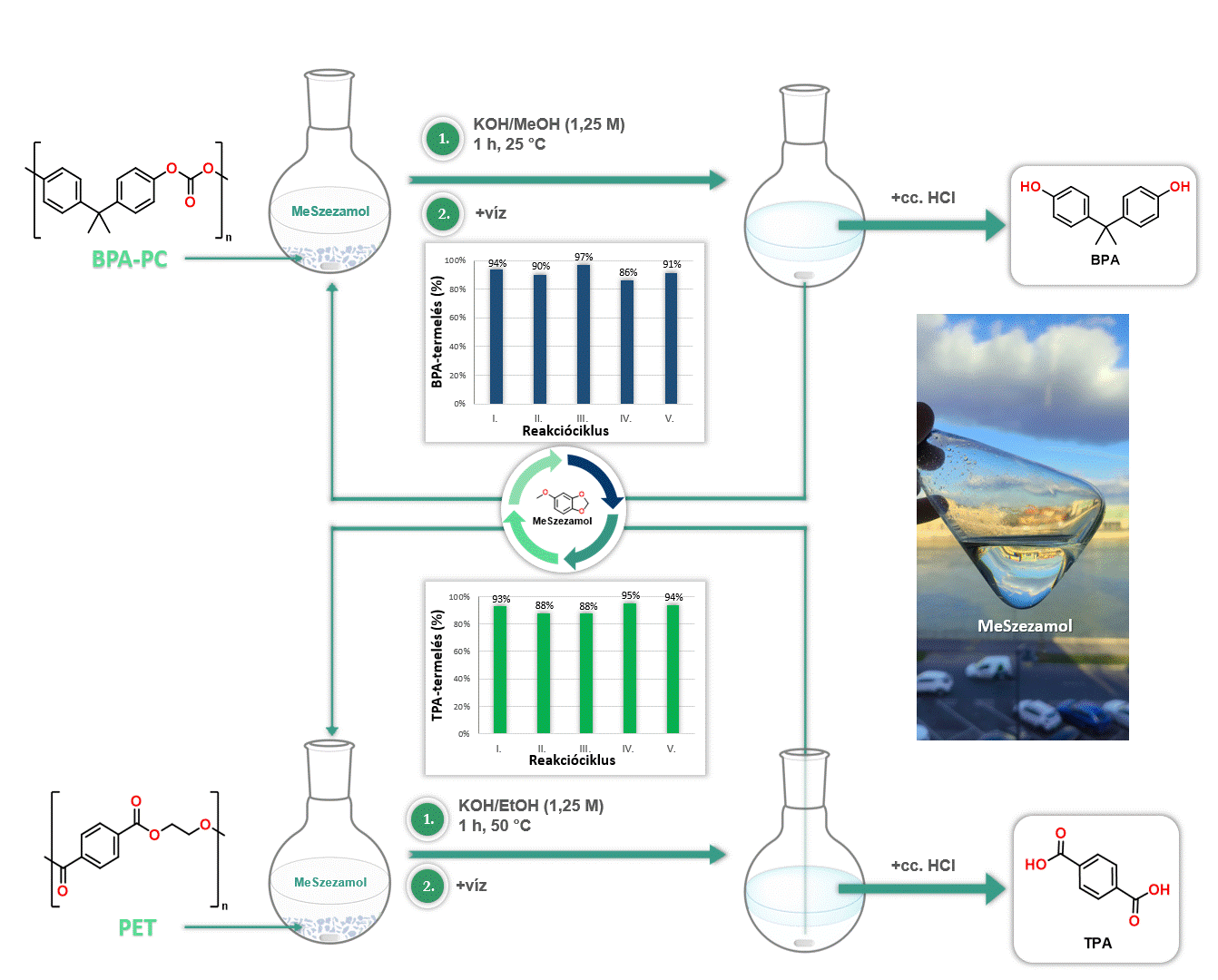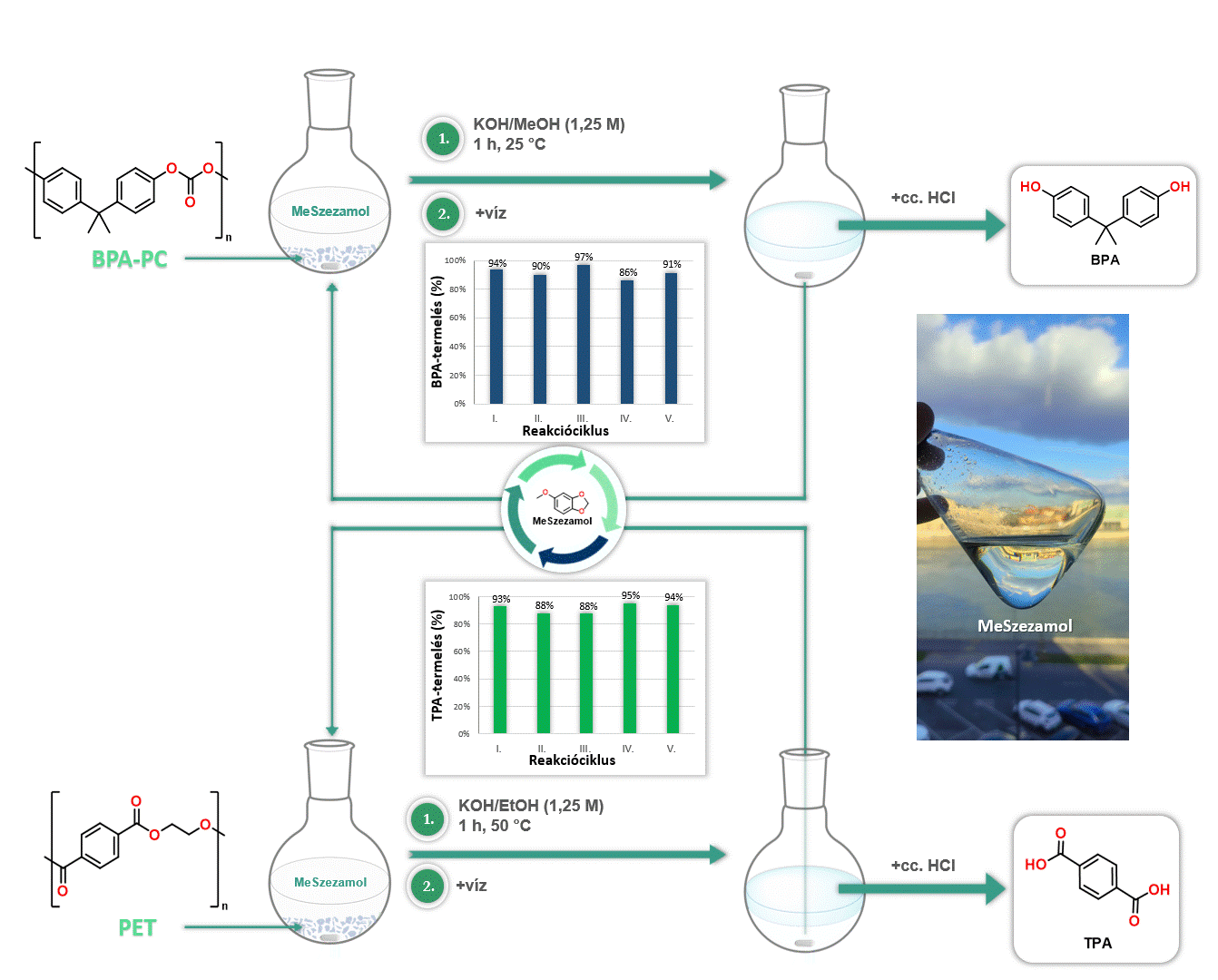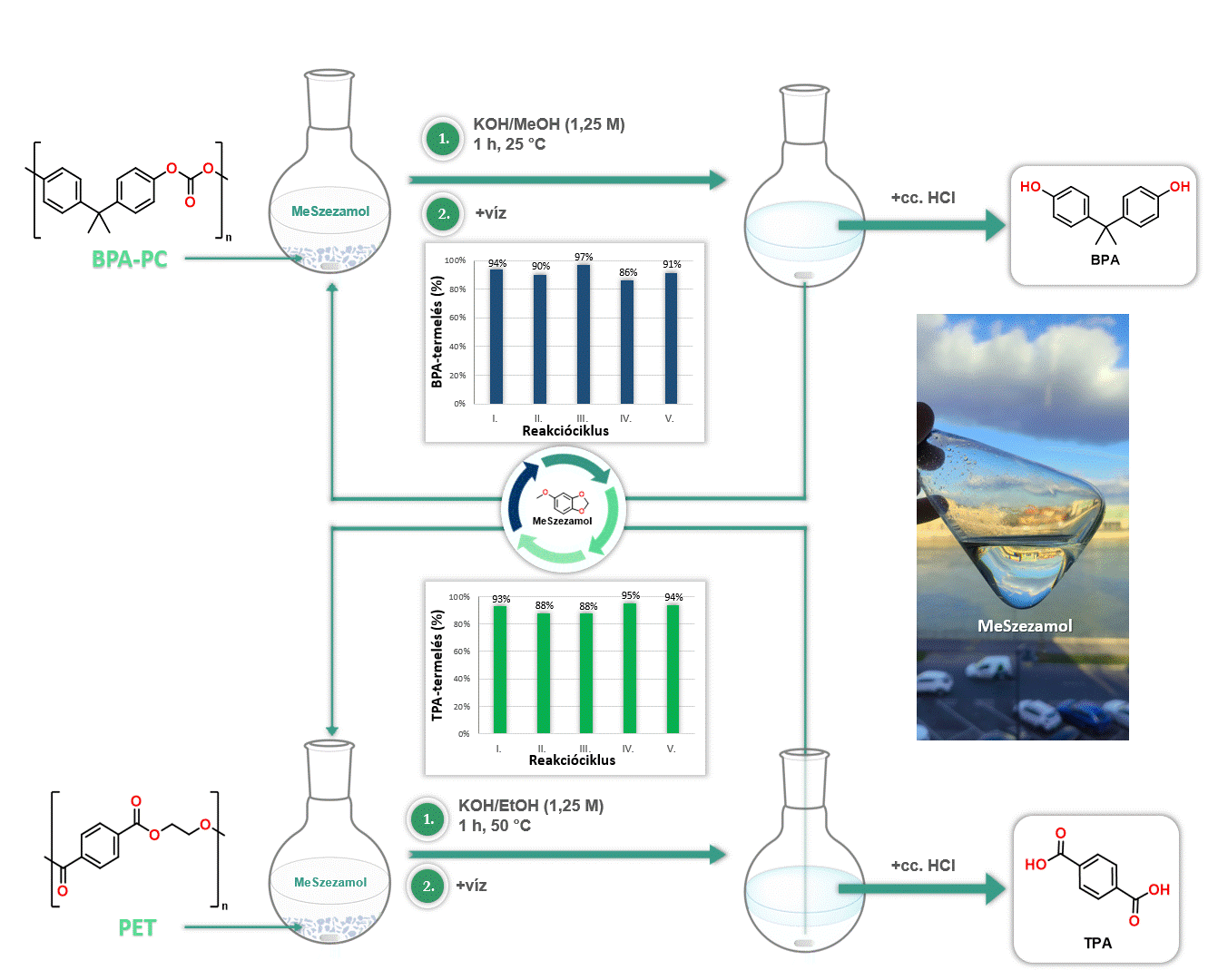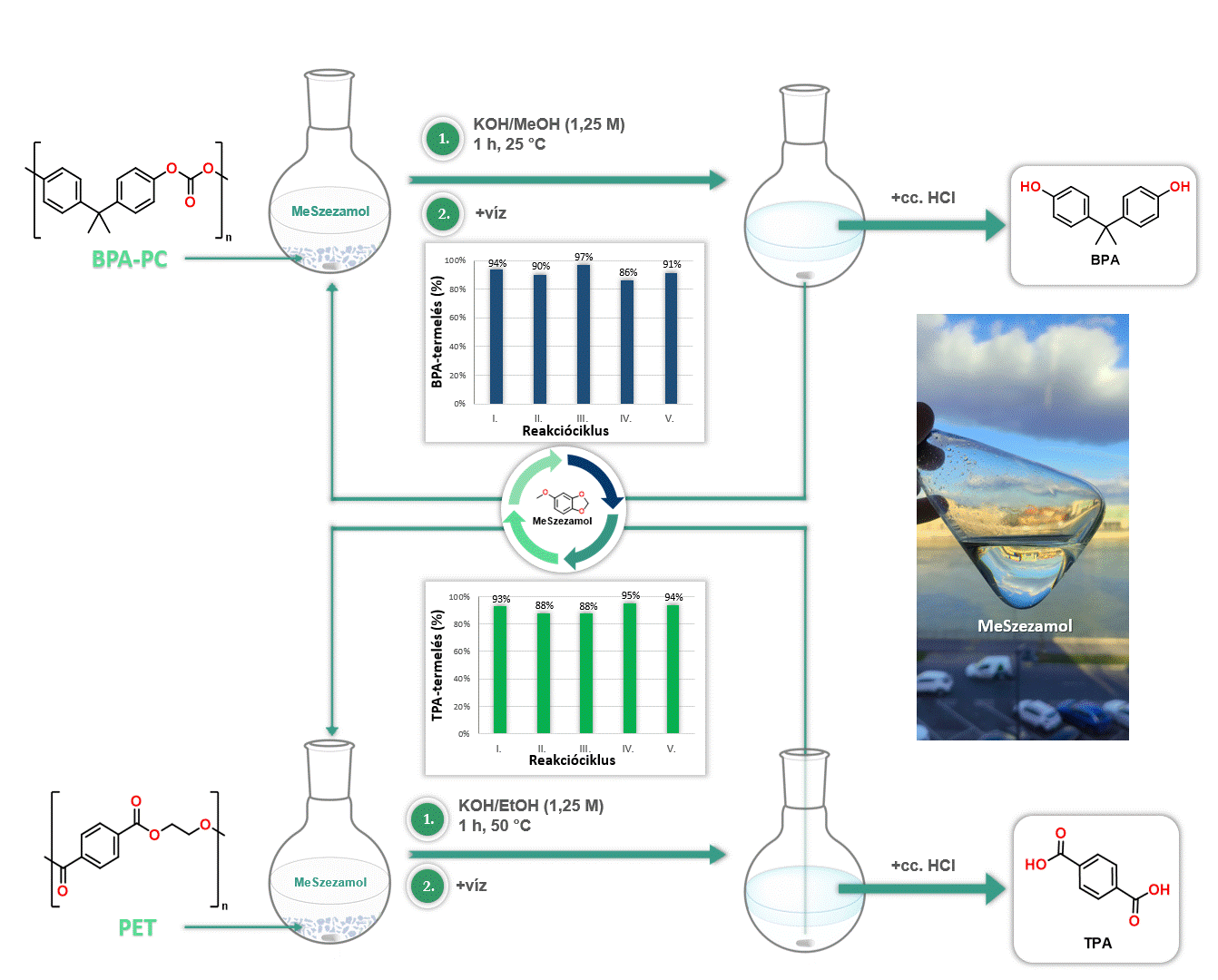
4. ábra MeSzezamol oldószerként történő alkalmazása polimer bontási reakciókban
Várható impakt, további kutatás
Az aszimmetrikus organokatalizátorok elterjedése a vegyiparban jelentős hatással lehet. Segítségükkel új típusú gyógyszerek állíthatók elő szelektíven, ami megkönnyíti az új terápiás célpontokra ható vegyületek kifejlesztését. Hatékonyságnövelésük nemcsak környezeti szempontból érezhető, hanem gazdaságilag is, mivel alkalmazásukkal csökkenthetők a termelési költségek. Az organokatalizátorok kutatása jelenleg is intenzíven folyik, ami további fejlődést és mélyebb megértést biztosíthat.
Az új típusú oldószerek fejlesztése számos területen hozhat változásokat a vegyiparban. Alkalmazásukkal csökkenhet a környezeti terhelés, és biztonságosabban, gyakran pedig hatékonyabban végezhetünk velük reakciókat, így innovatív technológiákhoz juthatunk. Kutatócsoportunkban jelenleg is folynak kutatások további új organokatalizátorok kifejlesztésére, valamint a MeSzezamol oldószerként történő alkalmazásának kibővítésére.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája. (IF: impakt faktor, Scimago-besorolás, IC: független hivatkozások)
Linkgyűjtemény.
Hivatkozások listája.
[1.] List, B.; Lerner, R. A.; Barbas, C. F. J. Am. Chem. Soc. 2000, 122, 2395–2396.
[2.] Ahrendt, K. A.; Borths, C. J.; MacMillan, D. W. C. J. Am. Chem. Soc. 2000, 122, 4243–4244.
[3.] MacMillan, D. W. C. Nature 2008, 455, 304–308.
[4.] Castelvecchi, D.; Stoye, E. Nature 2021, 598, 247–248.
[5.] Marcelli, T.; Hiemstra, H. Synthesis 2010, 2010, 1229–1279.
[6.] Lu, T.; Wheeler, S. E. Chem. Eur. J. 2013, 19, 15141–15147.
[7.] Han, B.; He, X.-H.; Liu, Y.-Q.; He, G.; Peng, C.; Li, J.-L. Chem. Soc. Rev. 2021, 50, 1522–1586.
[8.] Burke, A. J. Expert Opin. Drug Discovery 2023, 18, 37–46.
[9.] Clarke, C. J.; Tu, W.C.; Levers, O.; Bröhl, A.; Hallett, J. P. Chem. Rev. 2018, 118, 747–800.
[10.] Gu, Y.; Jérôme, F. Chem. Soc. Rev. 2013, 42, 9550–9570.
