|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
Alkalmazott Biotechnológia és Élelmiszertudományi Tanszék
Témavezető: Dr. Fehér Csaba
Agráripari melléktermékek komplex hasznosítása bakteriális és nemkonvencionális élesztőeredetű enzimek alkalmazásával, egyesített bioeljárásban
A kutatási téma néhány soros bemutatása
A lignocellulóz-alapú biomassza a legnagyobb mennyiségben előforduló nyersanyag napjainkban, amelynek feldolgozása máig nem teljeskörűen megoldott/kiaknázott. A biofinomítás erre kínálhat megoldást. Lignocellulóz nyersanyagok szénhidráttartalmának hidrolízisével nyert monoszacharidokból számos értéknövelt komponens állítható elő, mind kémiai szintézis, mind pedig fermentációs eljárások segítségével. Ilyen értéknövelt komponens például a xilit. A xilit, vagy egyéb termékek előállításának jó alternatívája lehet a biofinomító koncepció, ahol megvalósítható a lignocellulóz-alapú biomassza enzimes, mikrobiális lebontása, majd a bomlástermékek értékes termékké való alakítása. Bár a nemkonvencionális élesztők jelentős részéről ismert, hogy jó termékképző, az említett folyamat a napjainkig egy kevésbé kutatott terület. Ezért doktori munkám fő célkitűzése olyan nemkonvencionális élesztők felkutatása, amelyek (lignocellulózra nézve) rendelkeznek hidrolitikus enzimaktivitással, és emellett valamilyen értékes termék előállítására is képesek (pl. xilit, szerves savak stb.) egyesített bioeljárás megvalósításával.
A kutatóhely rövid bemutatása
Doktori kutatásomat az VBK ABÉT Tanszékén, a Biofinomító Kutatócsoportban végzem Dr. Fehér Csaba témavezetése alatt. Csoportunk évek óta a lignocellulóz-alapú melléktermékek értéknövelt termékké való alakításával foglalkozik, amely nem is lehetne aktuálisabb, hiszen egyre nagyobb teret hódít magának a fenntarthatóság és a körforgásos gazdaság megvalósítása, amelyek jó eszköze lehet a biofinomítás.
A kutatás történetének, tágabb kontextusának bemutatása
A nagy mennyiségben elérhető, megújuló, olcsó nyersanyagforrásnak tekinthető lignocellulóz melléktermékek hasznosítása gazdasági és társadalmi szempontból is rendkívül előnyös [1]. A lignocellulóz-alapú biomassza hasznosítását célzó ipari eljárások elterjedését azonban a mai napig gátolja az enzimek magas ára és a szükséges komplex, többlépéses technológia, amely nagy beruházási és üzemelési költségeket eredményez [2]. Számos lépés integrálása és hatékony enzimtermelés révén az egyesített bioeljárás egy költséghatékony megoldást jelenthet [3].
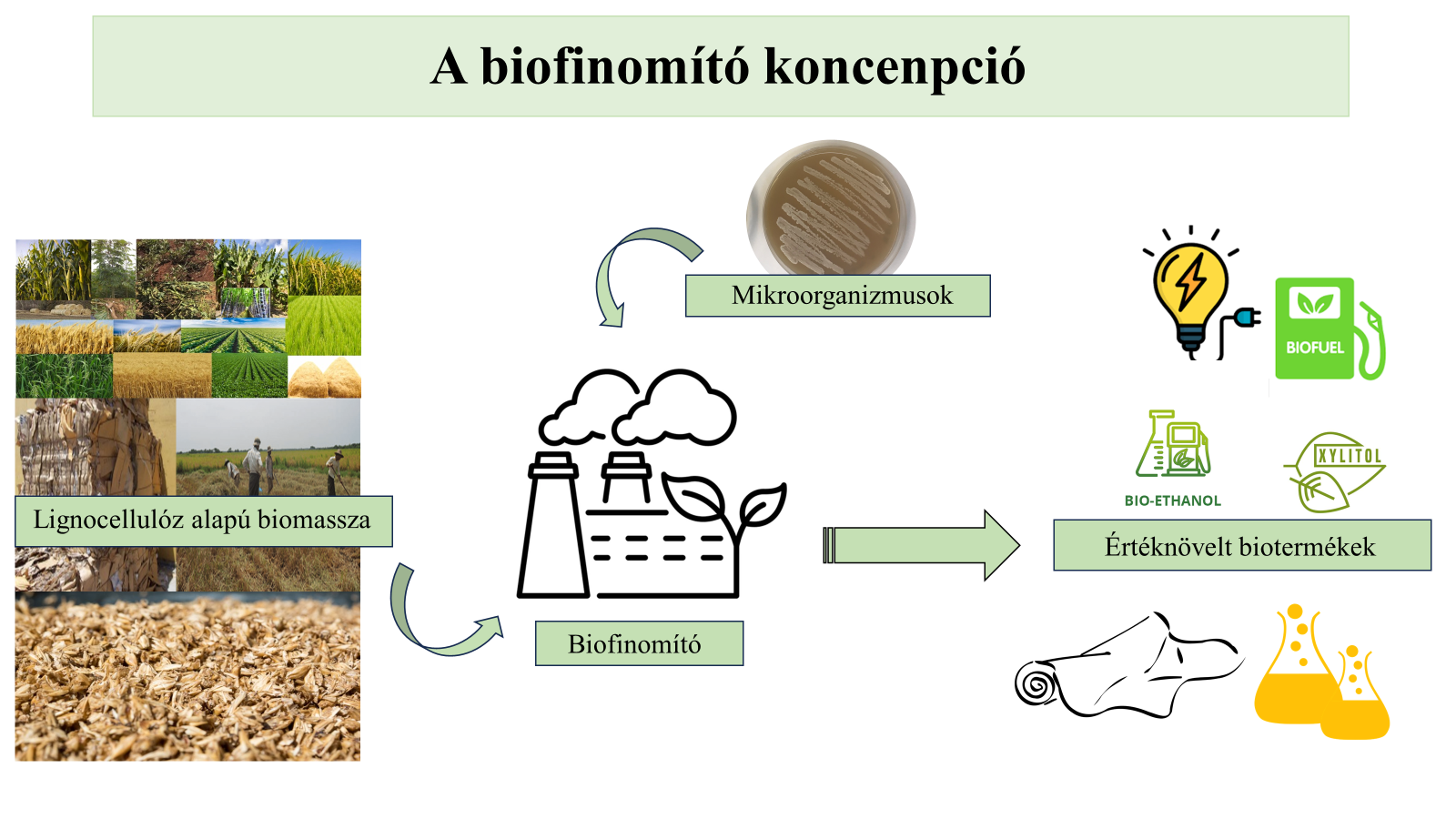
- ábra: A biofinomító koncepció
Az ehhez szükséges új mikroorganizmusok (baktériumok és élesztők) alapos vizsgálata így nemcsak a vonatkozó tudományterületek (élesztő és bakteriális mikrobiológia, fermentáció, biofinomítás, ipari biotechnológia) fejlődését szolgálja, de hozzájárulhat olyan környezeti és gazdasági szempontból fenntartható, ipari eljárások (biofinomítók) megvalósításához, amelyek lignocellulóz nyersanyagokból nagy hozzáadott értékű biotermékeket állítanak elő. Ezen egyesített biofinomító eljárások nélkülözhetetlenek egy körforgásos bioalapú gazdaság megvalósításához, így kutatásuk és fejlesztésük kiemelkedő gazdasági, környezeti és társadalmi jelentőséggel bír. Doktori kutatásom számos új tudományos eredmény elérésének lehetőségét tartogatja magában: nemkonvencionális élesztők és baktériumok hidrolitikus enzimkészletének vizsgálata és termelése, termékképző tulajdonságainak vizsgálata, monokultúrás és/vagy kevert tenyészetek egyesített bioeljárásban való alkalmazhatósága, bioeljárások hatékonyságának növelése paraméteroptimálással.
A kutatás célja, a megválaszolandó kérdések
Kutatásom fő célkitűzése lignocellulóz-alapú mezőgazdasági melléktermékek (pl. búzakorpa, sörtörköly, hulladékpapír) lebontása, majd értékes termékké (pl. xilit, etanol) való alakítása egyesített bioeljárás során, bakteriális és/vagy nemkonvencionális élesztőeredetű enzimek felhasználásával.
Kutatásom fő célkitűzései:
- Új baktérium- és nemkonvencionális élesztőtörzsek vizsgálata hidrolitikus enzimaktivitás és termékképzés tekintetében.
- Az enzimtermelő törzsek esetében az enzimaktivitás mérésének és az enzimtermelés optimális körülményeinek meghatározása.
- A termékképző törzsek esetében a termékek azonosítása, termelésük körülményeinek optimalizálása (különös tekintettel a xilitre).
- Jó enzimtermelő és termékképző tulajdonsággal rendelkező törzsek vizsgálata monokultúrás, illetve kevertkultúrás tenyészetekben.
- Egyesített bioeljárás megvalósítása monokultúrás vagy kevert kultúrás tenyészet alkalmazásával, rázatott lombikban, később laborfermentorban.
Módszerek
Cellulomonas phragmiteti baktérium xilanáz-termelésének vizsgálata
Az enzimtermelést aerob körülmények között szubmerz tenyészetekben vizsgáltuk különböző lignocellulóz-tartalmú melléktermékeken (hulladékpapír, búzakorpa, sörtörköly, rozskorpa, rizsszalma, DDGS). A xilanázaktivitás mérése során a redukáló cukrok mérésére DNS-módszert alkalmaztunk. A xilanáz mellett egyéb aktivitásokat is megvizsgáltunk: CMC-áz, β-xilozidáz, β-glükozidáz, arabinofuranozidáz és cellobiohidroláz. A CMC-áz aktivitást szintén DNS-módszerrel, a további aktivitásokat p-nitrofenol felszabadulásán alapuló méréssel végeztük. A C. phragmiteti által termelt xilanáz enzim aktivitását pH 3–11, illetve 25–85 ℃ tartományokon vizsgáltuk a működési optimuma meghatározása céljából. 45 ℃-on és 55 ℃-on enzimstabilitási vizsgálatot is végeztünk.
Nemkonvencionális élesztőtörzsek hidrolitikus enzimtermelésének vizsgálata
Az általunk vizsgálni kívánt törzsek a következők: Komagataella pseudopastoris, Spencermartinsiella sp., Spencermartinsiella ligniputrida, Spencermartinsiella europaea, Sugiyamaella novakii, Kuraishia molischiana, Candida maritima, Candida hawaiinensis, Scheffersomyces stipitis, Candida allociferri, Ogatae pilisensis, Geotrichum klebahnii és Candida baotianensis. Az élesztőtörzsekkel először xilánnal kiegészített szilárd táptalajon kioltási zóna tesztet végeztünk Kongóvörös festési technikával. Azoknál a törzseknél, ahol feltisztulási zónát detektáltunk, xilánmodell-szubsztráton, aerob körülmények között, szubmerz tenyészeteket készítettünk. Az előállított fermentlevekből xilanázaktivitást mértünk, szintén DNS-módszerrel, illetve a C. phragmiteti esetében említett egyéb aktivitásokat is tervezzük vizsgálni. Azokban az esetekben, ahol xilanázaktivitást tapasztalunk, az aktivitásmérés és az enzimtermelés körülményeit is optimalizálni szeretnénk.
Nemkonvencionális élesztőtörzsek termékképzésének vizsgálata
A törzseket különböző szénforrásokon (glükóz, xilóz, arabinóz stb.), különböző körülmények (aerob, mikroaerob, anaerob) között tenyésztjük, naponta mintázzuk, a sejttömeg-növekedés vizsgálata céljából, illetve a minták sejtmentes felülúszóját előkészítjük, és HPLC segítségével követjük a szénforrás fogyásának alakulását, és azonosítjuk a lehetséges termékeket.
Candida baotianensis xilittermelésének optimalizálása
Rázatott lombikos kísérletek keretein belül vizsgáltuk az élesztőtörzs xilittermelésének optimális körülményeit (levegőztetés, tápközeg, hőmérséklet, pH). Kísérlettervezés (teljes faktoriális, ortogonális kísérleti terv (32)) segítségével pedig vizsgáljuk, hogy a lombik töltöttségi szintje, illetve a kiindulási xilózkoncentráció milyen hatással vannak a xilithozamra és az ehhez tartozó produktivitásra.
Eddigi eredmények
Cellulomonas phragmiteti által termelt xilanáz jellemzése
Megállapítottam, hogy a tesztelt lignocellulóz-alapú melléktermékek és a tesztelt tápközegek (Luria-Bertani (LB), Minimál (MM), King’s B) közül a hulladékpapírral kiegészített LB tápközeg a legalkalmasabb a C. phragmiteti xilanáz termeléséhez.
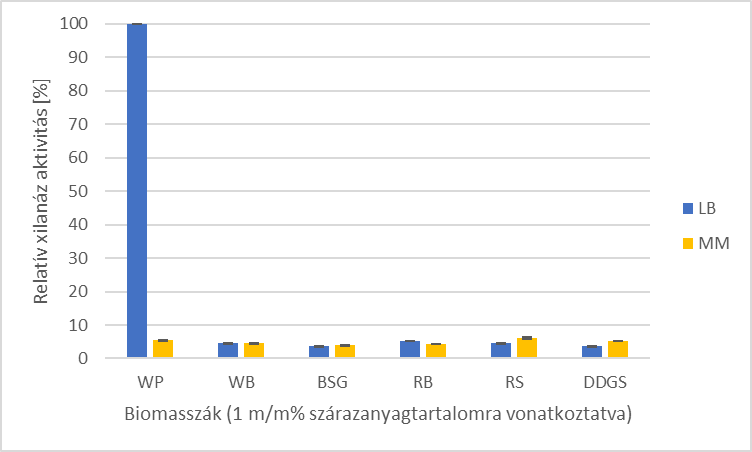
2. ábra -
Relatív xilanázaktivitások a különböző lignocellulóz-alapú biomasszákon
WP-hulladékpapír, WB-búzakorpa, BSG-sörtörköly, RB-rozskorpa, RS-rizsszalma,
DDGS-szárított gabonatörköly kukoricából
Ezt követően vizsgáltam, hogy a hulladékpapír különböző koncentrációi hogyan befolyásolják az enzimtermelést. A legnagyobb enzimaktivitás értéket (15,3 U/mL) 1 m/m% alkalmazásával sikerült elérni.
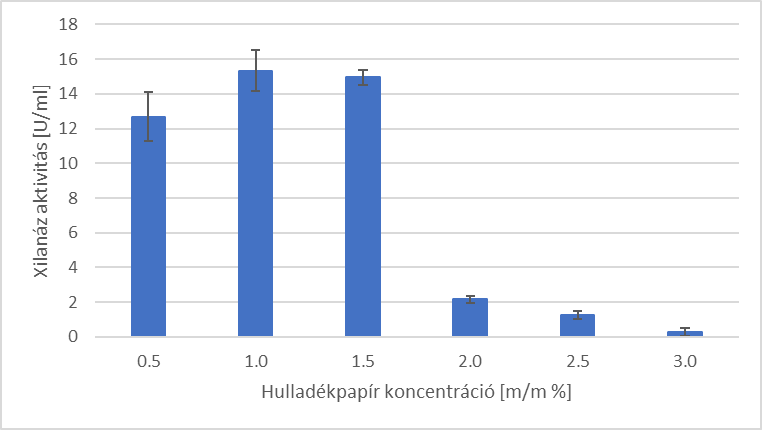
3. ábra - Enzimaktivitás [U/ml] -értékek a különböző hulladékpapír koncentrációk mellett
Mellékaktivitások tekintetében kis értékeket mértünk; ezek közül a legnagyobb a β-xilozidáz volt (0,61 U/ml). Mivel a C. phragmiteti baktériumot sótoleránsnak jellemezték, ezért vizsgáltuk a NaCl hatását az enzimaktivitásra. A megtermelt xilanáz 200 g/l NaCl mellett is képes volt megtartani aktivitásának 67%-át, ami arra utal, hogy az enzim is rendelkezik halotoleráns tulajdonsággal. Emellett a xilanáz pH 5 és 8, illetve 45–55 ℃ közötti tartományon működik optimálisan; a maximális aktivitását pH 6 és 45 ℃-on detektáltuk.
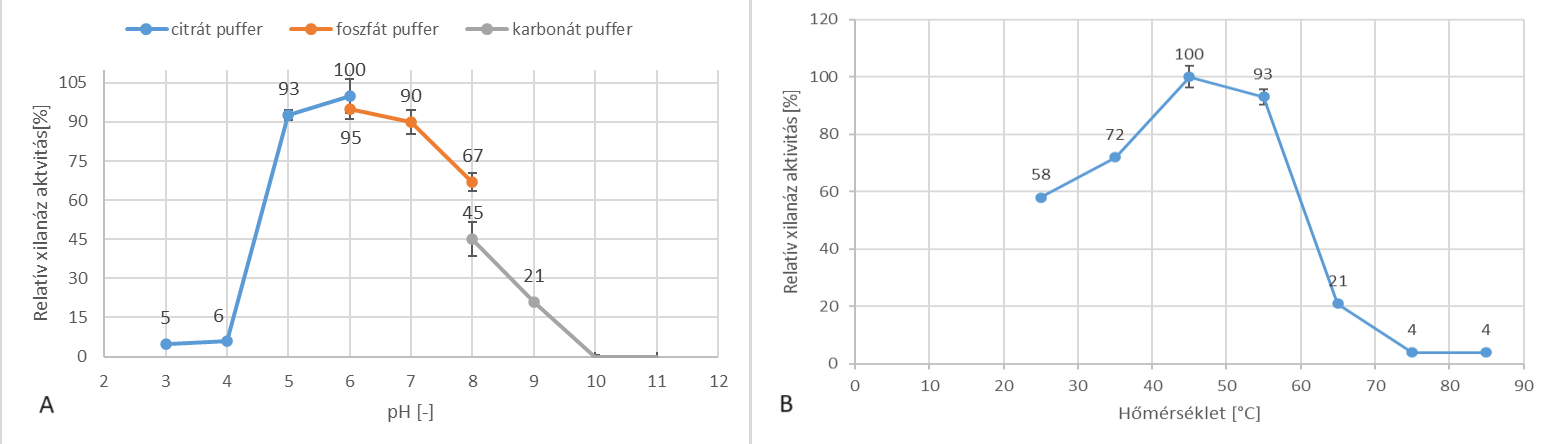
4. ábra - C. phragmiteti által termelt xilanáz enzim pH- és hőmérsékletoptimum-keresési kísérleteinek eredményei
Az enzimstabilitás vizsgálatok eredményei alapján jól látható, hogy az enzim 45 ℃-on stabilabb, mint 55 ℃-on. pH 6 beállításon az enzim 45 ℃-on 72 óra elteltével is megtartotta aktivitásának közel 60%-át, ezzel szemben 55 ℃-on az aktivitások 72 óra után 2–12% közé csökkentek.
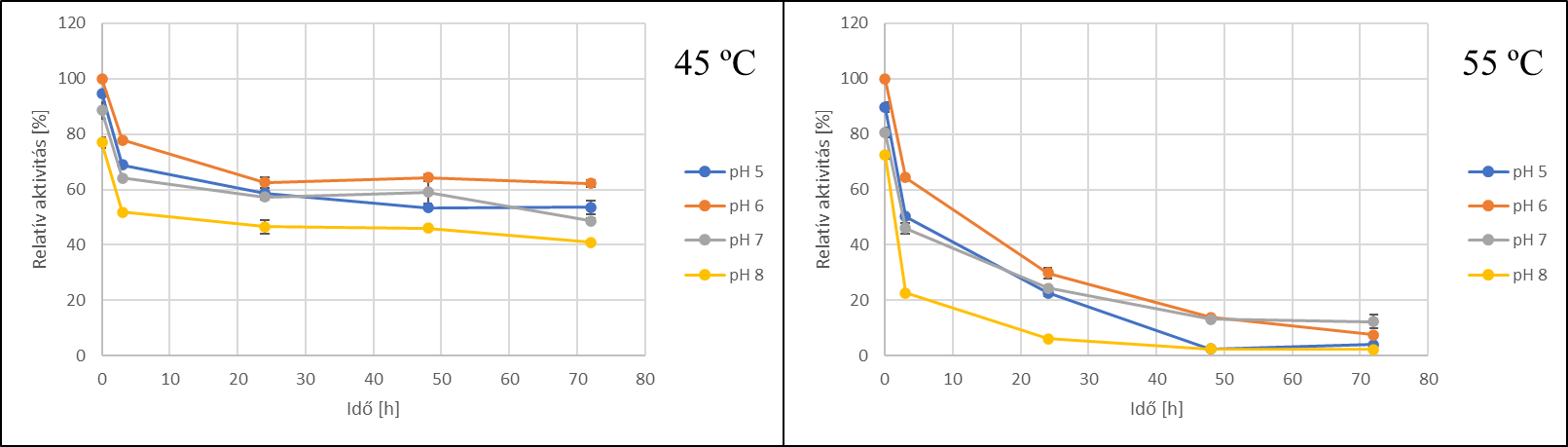
5. ábra - A C. phragmiteti által megtermelt enzim stabilitásvizsgálatának eredményei
Nemkonvencionális élesztők hidrolitikus aktivitásának és xilittermelésének vizsgálata
Az általam vizsgált nemkonvencionális élesztők közül a S. europaea és a S. novakii esetében figyeltünk meg hidrolitikus enzimaktivitást xilán szubsztrátra nézve, mind szilárd táptalajon, mind szubmerz tenyészetben. A xilanázaktivitás optimális mérési körülményeinek és az enzimtermelés optimális körülményeinek meghatározásához azonban még további kísérletekre van szükség.
Xilittermelést tapasztaltunk a következő élesztőknél: S. novakii, K. molischiana, S. stipitis, C. allociferri és C. baotianensis. Ezek közül a K. molischiana és C. baotianensis esetében detektáltuk a legnagyobb xilitkoncentrációkat. Jelenleg a C. baotianensis xilittermelésének optimalizálásával foglalkozunk, későbbiekben a K. molischiana élesztővel is tervezünk hasonlóan eljárni.
1.táblázat - Xilittermelő törzsek és a velük mért legnagyobb xilitkoncentrációk
|
Élesztő |
Mért legnagyobb xilitkoncentráció [g/l] |
Xilitkoncentrációhoz tartozó mintavételi időpont |
|
K. molischiana |
16,7 |
48 óra |
|
S. novakii |
5,9 |
72 óra |
|
C. allociferri |
2,5 |
72 óra |
|
S. stipitis |
2,1 |
72 óra |
|
C. baotianensis |
18,1 |
72 óra |
C. baotianensis élesztőtörzsről napjainkig elég kevés irodalom lelhető fel, így először e törzs xilittermelésének optimális körülményeinek meghatározásával foglalkoztunk.
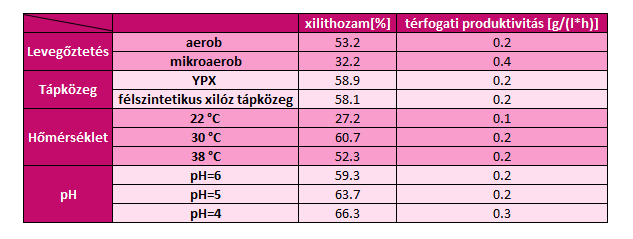
6. ábra - C. baotianensis xilittermelésének vizsgálata és a hozzá tartozó hozamok és térfogati produktivitások
A C. baotianensis xilittermelésének optimális körülményei: mikroaerob tenyésztés, 30 ℃, pH 4. A tápközegek összehasonlításában nem tapasztaltunk nagy különbséget, így a félszintetikus xilóz tápközeget választottuk, ugyanis ez a xilóz mellett kevés élesztőkivonatot és szervetlen sókat tartalmaz, ezáltal ez egy olcsóbb megoldás, mint az élesztőkivonatban és peptonban gazdag YPX tápközeg.
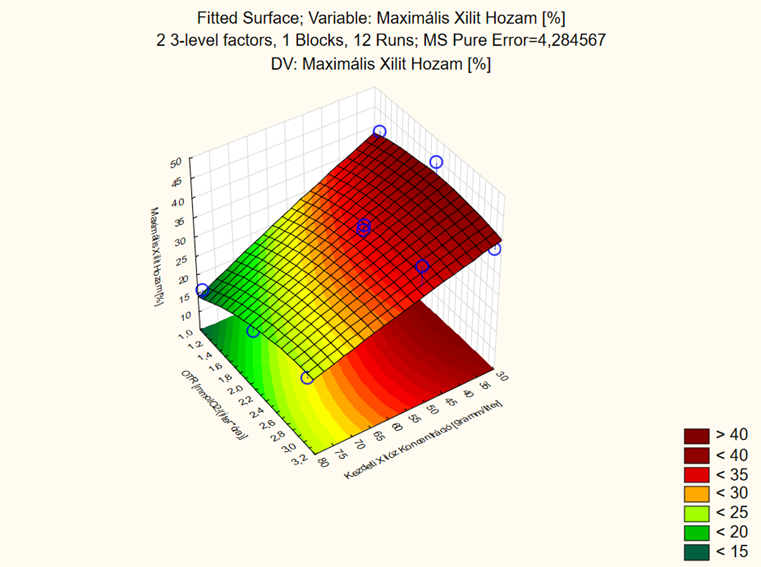
7. ábra - A C. baotianensis élesztővel tervezett xilitfermentációs kísérlet értékelése során a maximális xilithozamra illesztett felület
A 32 kísérleti terv alapján elvégzett kísérletek eredményeként elmondható, hogy mind a kiindulási xilózkoncentráció, mind a lombik töltöttségi szintje befolyásolja a maximális xilithozam értékét. A minél nagyobb hozam elérése érdekében vagy kisebb (1–2,4 mmol O2/(l*h)) OTR értékeket kell kisebb (30–35 g/l) kiindulási xilózkoncentrációval társítani, vagy nagyobb (2,4–3,2 mmol O2/(l*h)) OTR értékeket kell nagyobb (50–55 g/l) kezdeti xilózkoncentrációval kombinálni. A kapott modellt verifikálása folyamatban van.
Várható impakt, további kutatás
Napjainkban egyre fontosabb váló téma a fenntarthatóság és a környezetvédelem. A körforgásos biogazdaság megvalósítása, a lignocellulóz-alapú biofinomítók egyesített bioeljárással való üzemeltetése és fejlesztése megoldást jelenthet az értékes termékek költséghatékonyabb és egyben környezetbarátabb előállítására.
A későbbiekben a cél a mezőgazdasági ipari melléktermékek lebontása, majd a bomlástermékként kapott cukrok értékes termékké (pl. xilit) történő biokonverziója egyesített bioeljárás megvalósításával laborfermentorban, monokultúrás vagy kevert tenyészetes kivitelezésben. A kevert tenyészetes megoldás potenciális szereplői lehetnek a C. phragmiteti a xilanáztermelő, valamint a C. baotianensis pedig kitűnő xilittermelő képessége miatt.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája:
Kata Buda, Tünde Fekete, Ornella M. Ontanon, Eleonora Campos, Csaba Fehér (2024). Xylanase Production by Cellulomonas phragmiteti Using Lignocellulosic Waste Materials, Processes, 2024, 12, 258, https://doi.org/10.3390/pr12020258
Hivatkozások listája:
[1] Y.J. Bomble, C.Y. Lin, A. Amore, H. Wei, E.K. Holwerda, P.N. Ciesielski, B.S. Donohoe, S.R. Decker, L.R. Lynd, M.E. Himmel, Lignocellulose deconstruction in the biosphere, Curr Opin Chem Biol 41 (2017) 61–70. https://doi.org/10.1016/j.cbpa.2017.10.013.
[2] T. Hasunuma, F. Okazaki, N. Okai, K.Y. Hara, J. Ishii, A. Kondo, A review of enzymes and microbes for lignocellulosic biorefinery and the possibility of their application to consolidated bioprocessing technology, Bioresour Technol 135 (2013) 513–522. https://doi.org/10.1016/j.biortech.2012.10.047.
[3] S. Bedő, A. Fehér, P. Khunnonkwao, K. Jantama, C. Fehér, Optimized bioconversion of Xylose derived from pre-treated crop residues into Xylitol by using Candida Boidinii, Agronomy 11 (2021). https://doi.org/10.3390/agronomy11010079.
