|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Hirsch Edit
Valós-idejű folyamatkövetés és szabályozás biohatóanyagok minőségének biztosítására
A kutatási téma néhány soros bemutatása
Az elmúlt évtizedben a biohatóanyagok, főként a monoklonális antitestek (mAb) iránti kereslet jelentősen megnőtt a gyógyszerkészítmények piacán [1]. Mivel azonban ezek a fehérje típusú hatóanyagok rendkívül nagy mérettel és komplex szerkezettel rendelkeznek, az állandó minőségű, hatékony és biztonságos előállításuk számos nehézség elé állítja a gyógyszergyártókat.
A mAb-ok gyártási folyamata sok egymást követő bonyolult lépések sorozatából tevődik össze, amely alapvetően három nagy részre osztható fel: a fehérje termelésére sejtes rendszerekben (upstream); az előállított hatóanyag tisztítására (downstream); illetve gyógyszerkészítménnyé alakítására (formuláció). A gyártás során a fő kihívást az jelenti, hogy a termék minőségét valamennyi folyamatparaméter érzékenyen befolyásolhatja. Ennek következtében elengedhetetlen megfelelően monitorozott és szigorúan szabályozott körülmények biztosítása a teljes előállítási folyamat során, amihez új innovatív technológiák kifejlesztésére van szükség.
A kutatóhely rövid bemutatása
A kutatásomat Dr. Marosi György és Dr. Nagy Zsombor irányításával működő FirePharma kutatócsoportban végzem. A csoport munkájának fókuszában olyan automatizált és magas szintű szabályozással ellátott innovatív technológiák kifejlesztése áll, amelyek a jövőben a hatékony, biztonságos és magas minőségű gyógyszergyártás alapjául szolgálhatnak.
A kutatás történetének, tágabb kontextusának bemutatása
A nagy molekulaméretű és komplex szerkezetű monoklonális antitestek a hagyományos, szintetikus úton nem állíthatók elő, így emlőssejtek bioreaktoros tenyésztését alkalmazzák [2]. A folyamat során a megfelelő tenyésztési körülmények biztosítása kulcsfontosságú, mivel ezek az élő szervezetek nagyon érzékenyek az őket körülvevő környezeti változásokra [3]. Már egy-egy folyamatparaméter kismértékű módosulása is nagy hatással lehet a sejtek növekedésére és életképességére, valamint a monoklonális antitestekre egyaránt. A megfelelő minőségű és mennyiségű termék elérése érdekében elengedhetetlen, hogy a tenyésztés során végbemenő komplex folyamatok tanulmányozásával minél jobban megértsük az egyes tenyésztési paraméterek termelt fehérjére gyakorolt hatását.
A 2004-ben kiadott Process Analytical Technology (PAT) kezdeményezés óta a kritikus paraméterek vizsgálatára a gyógyszeripar az inline és online analitikai módszereket részesíti előnyben, mivel gyorsan, roncsolásmentesen és mintavételezés nélkül, valós időben képesek értékes információt szolgáltatni [4]. A bioreaktoros tenyésztésnél a klasszikus fiziko-kémiai paraméterek (pl. pH, a hőmérséklet vagy oldott oxigén) mérésére alkalmas inline/online szenzorokat már széles körben alkalmazzák [5]. Azonban számos egyéb kritikus paraméter, mint a tápanyag- és melléktermék koncentrációk, az élő sejtszám vagy a termelt fehérje koncentráció, inline analízise az iparban még nem megoldott, így meghatározásuk jelenleg napi mintavételezés útján, időben és/vagy térben elkülönülő (atline és offline) analitikai vizsgálatokkal történik. Ezek a módszerek azonban jelentősen megnehezítik a folyamatba történő azonnali beavatkozást, így növelve az esélyt a rossz minőségű, selejtes termék előállítására.
A kutatás célja, a megválaszolandó kérdések
A kutatási munkám célja a monoklonális antitestet termelő emlőssejtek bioreaktoros tenyésztésének fejlesztése, különös hangsúlyt fektetve a PAT elveinek, valamint a fejlett szabályozási stratégiák gyakorlati alkalmazására. Inline analitikai módszerként a PAT ígéretes eszközét, a Raman-spektroszkópiát alkalmazom, mivel lehetőséget ad a tenyésztés során több különböző kritikus folyamatparaméter egyidejű mérésére. Munkám középpontjában a sejtek számára nélkülözhetetlen tápanyagok (glükóz és aminosavak), valamint a metabolizmus során keletkező káros melléktermékek (laktát és ammónia) koncentrációjának vizsgálata áll.
A kifejlesztett Raman-spektroszkópia-alapú monitorozó- és szabályozórendszer alkalmazásával szeretném mélyebben megismerni és megérteni a tenyésztés során végbemenő komplex és dinamikusan változó biológiai folyamatokat. Ezáltal lehetőségem nyílik olyan tápanyag-beadagolási stratégiák kidolgozására, amelynél a sejtek szükségletei alapján, automatizált rendszer segítségével történik a tápanyagok frissítése. A kutatás során a célom a kritikus tápanyag- és melléktermék-komponensek koncentrációjának optimális tartományon belüli tartása, ami kedvezőbb tenyésztési körülményeket biztosít a sejtek számára, és lehetővé teszi a megfelelő minőségű monoklonális antitestek robosztus és reprodukálható termelését.
Módszerek
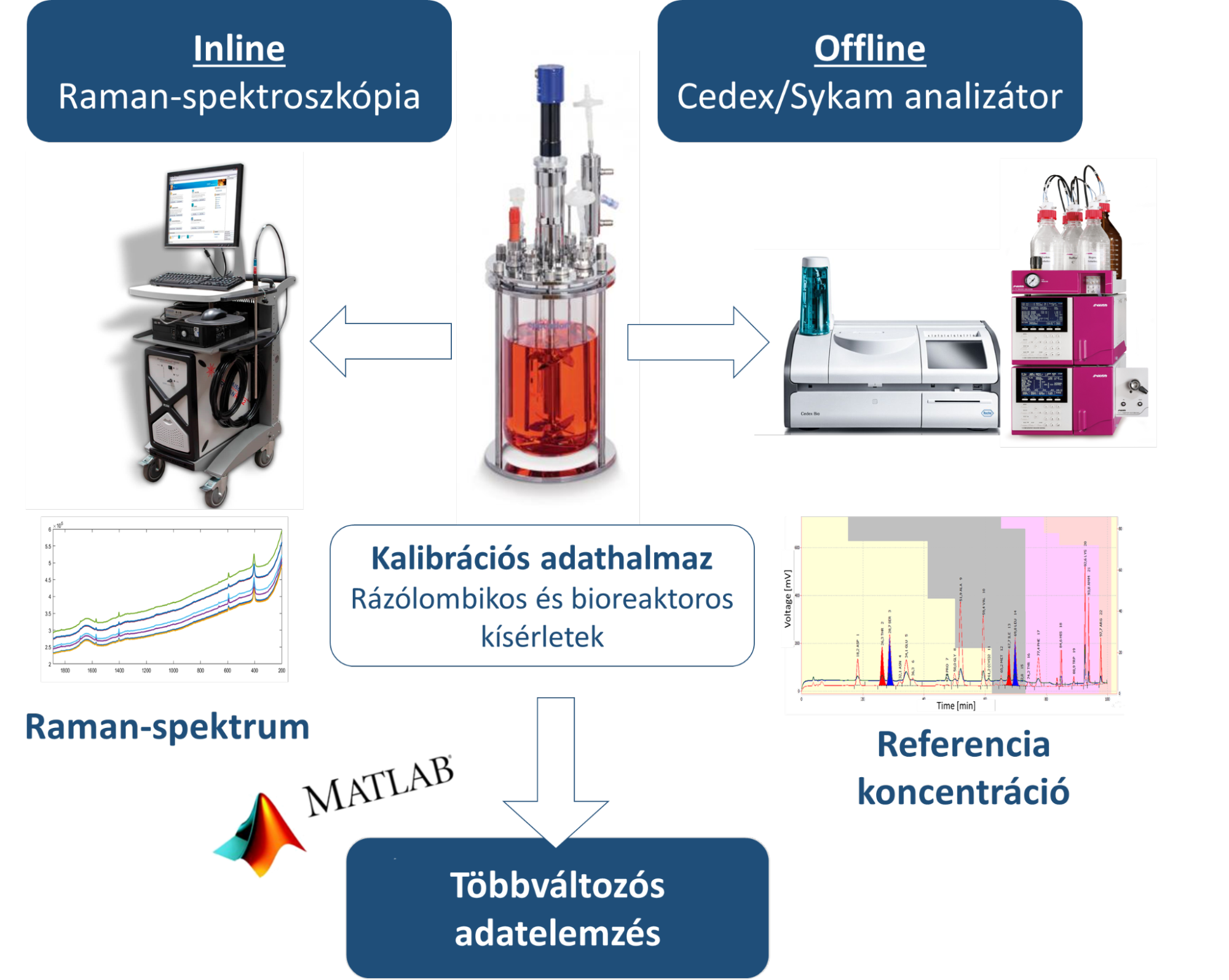
A kutatásom során adalimumab-termelő kínai hörcsög petefészek (Chinese Hamster Ovary, CHO) sejtvonal bioreaktoros tenyésztésével foglalkozom. Kezdetben a tenyésztés kis léptékben, rázólombikos edényekben és inkubátorban (36,5 °C és 5% CO2) történik, később pedig a nagyobb léptékű, keverővel ellátott (2 liter hasznos térfogatú) üveg bioreaktorban. A bioreaktor a kritikus tenyésztési paraméterek monitorozására a következő inline szondákkal van felszerelve: hőmérő, pH-szonda, oldottoxigén-mérő szonda, dielektromos spektrométer (élősejtszám-szenzor) és a Raman-spektrométer immerziós szondája (1.ábra).
A tenyésztés során a sejtek számára szükséges tápanyagok frissítése többkomponensű feed oldatok (Feed A és Feed B) és glükóz oldat beadagolásával történik. A reaktorból naponta 1–2 alkalommal van mintavétel, amely során atline mikroszkópos módszerrel vizsgálom az élő és halott sejtek számát, illetve az életképességet. A minta lefagyasztását követően későbbi offline méréssel történik a különböző tápanyag- és melléktermék-koncentrációk (glükóz, aminosavak, laktát és ammónia) meghatározása Cedex bioanalizátorral és Skyam automata aminosav-analizátorral.
1.ábra Emlőssejtek bioreaktoros tenyésztésének felépítése, inline Raman-spektroszkópiás méréssel
A Raman-spektroszkópia a monokromatikus fénysugár rugalmatlan szóródásán alapuló rezgési spektroszkópiai módszer. A Raman-spektrum egyfajta ujjlenyomat, ahol minden egyes csúcs, illetve sáv a molekula egy adott, specifikus rezgésének feleltethető meg. A mérés nagy előnye, hogy kvalitatív és kvantitatív információt is képes szolgáltatni az adott mintáról. A sejttenyésztés kritikus paramétereinek kvantitatív elemzéséhez a Raman-spektrumok kiértékelése sokváltozós adatelemzési módszerrel történik. A biotechnológia területén az egyik leggyakrabban a részleges legkisebb négyzetek (Partial Least Squares, PLS) módszerét alkalmazzák [6]. A kiértékelést megelőzően a felvett spektrumokon különböző matematikai előfeldolgozási műveletek (alapvonal-korrekciót, normálást és centrálást) elvégzése szükséges annak érdekében, hogy a zavaró hatásokat (pl. fluoreszcens háttérsugárzás, gázbuborékok megjelenése, detektorzaj) csökkentsük vagy eltávolítsuk.
Eddigi eredmények
A kutatásom során az emlőssejtes tenyésztés inline Raman-spektroszkópiás vizsgálatához elsőként kalibrációs modelleket fejlesztettem a különböző tápanyag- és melléktermék-koncentrációk meghatározására. A mérés robusztusságának érdekében fontos volt, hogy nagy adathalmaz álljon rendelkezésemre, amely jól leírja a rendszer biológiai variabilitását. A 2. ábrán látható szemléltetve a PLS-modellfejlesztés menete, amelynél kilenc rázólombikos és hét bioreaktoros tenyésztési kísérlet adatait használtam fel. Ez összesen 204 Raman-spektrum- és a hozzátartozó offline koncentráció- (glükóz, laktát, aminosavak) adatpárt jelentett.
2.ábra Kalibrációs modell fejlesztésének menete PLS-módszer alkalmazásával
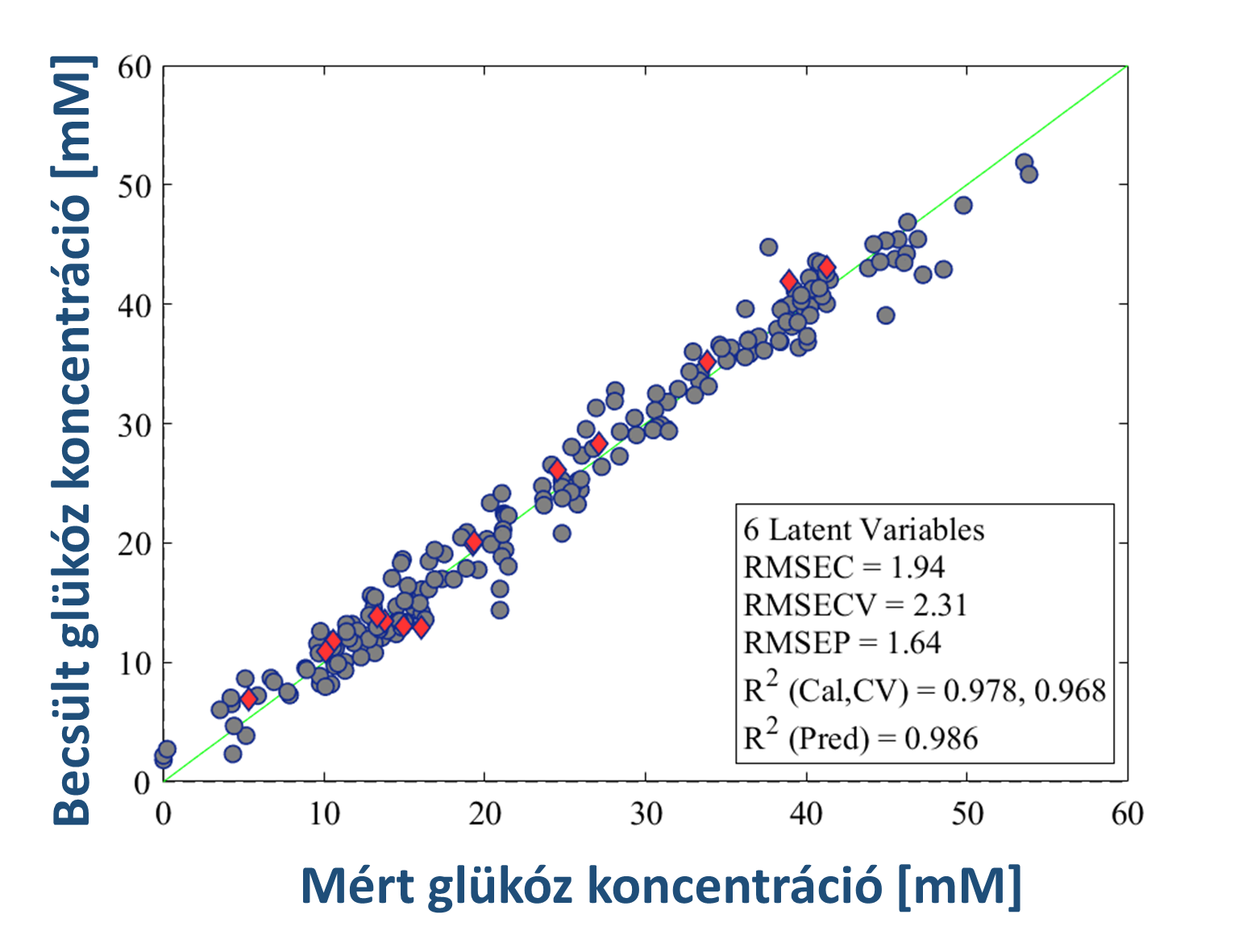
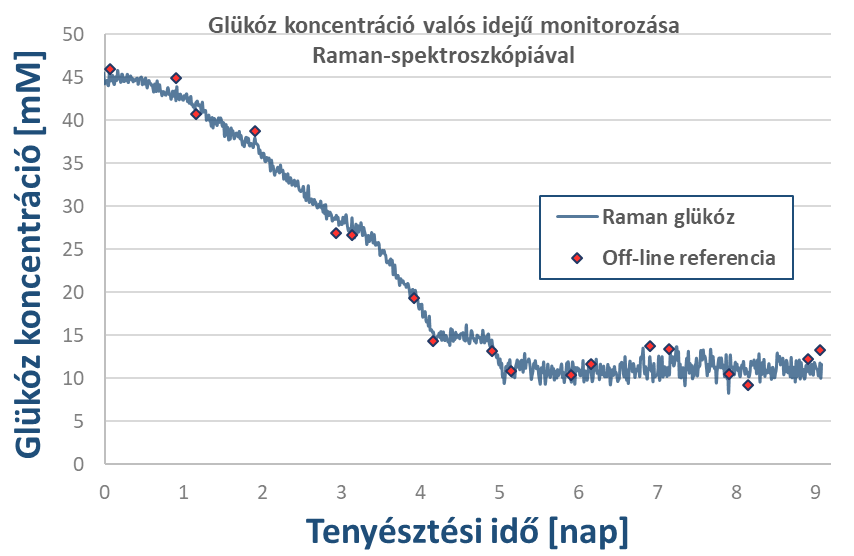
A PLS-módszert alkalmazva pontos és megbízható kalibrációs modelleket tudtam felépíteni a glükóz és laktát mellett 16 aminosav-komponensre. A 3.ábrán példaként a glükózra épített PLS-modell által mért és becsült koncentrációértékek közötti korreláció látható. A kalibrációs modelleket egy független bioreaktoros tenyésztési kísérletnél validáltam, amely során a Raman-mérés valós időben is jól tudta követni az egyes komponensek koncentrációváltozását (3.ábra).
3.ábra Glükózra épített PLS kalibrációs modell (bal), a modell validációja egy független bioreaktoros kísérlet Raman-spektroszkópiás monitorozása során (jobb)
Ezt követően a kifejlesztett Raman-alapú monitorozó- és szabályozórendszer alkalmazásával olyan dinamikus tápanyag-adagolási stratégiákat valósítottam meg, ahol a cél a sejtek számára szükséges tápanyagok állandó értéken tartása volt koncentrált glükóz oldat, valamint többkomponensű feed oldatok beadagolásának szabályozásával. A rátáplálások szabályozása a valós időben mért glükóz- (glükóz oldat) és arginin- (feed oldatok) koncentrációk alapján, automatizált pumpavezérléssel valósult meg (4.ábra).
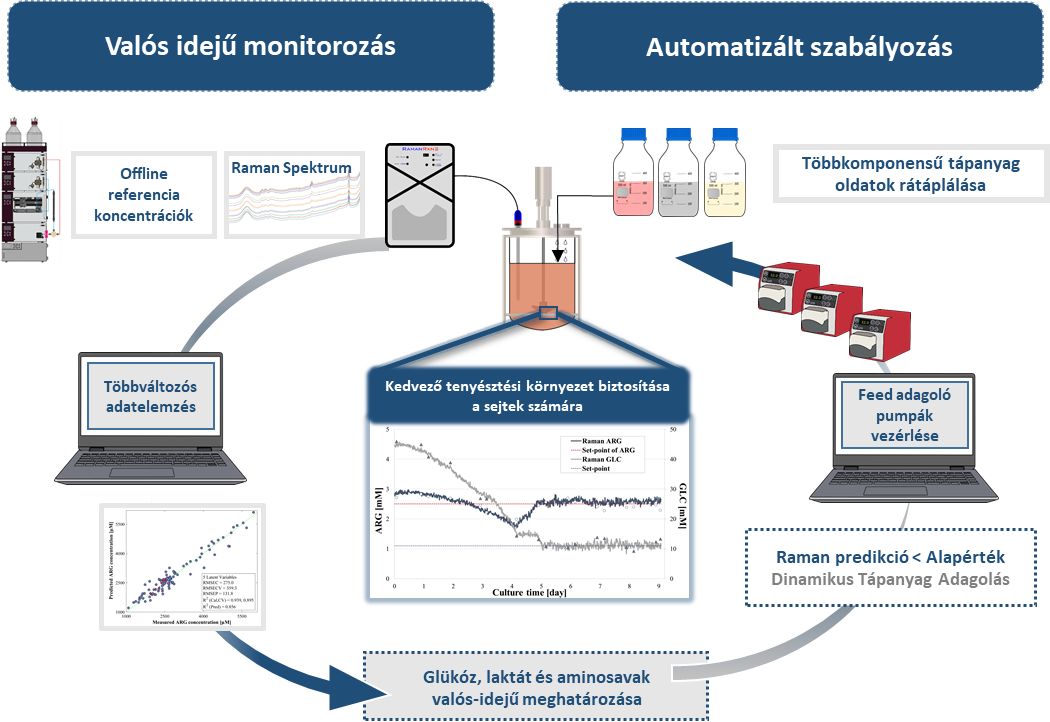
4.ábra Saját fejlesztésű, automatizált monitorozó- és szabályozórendszer, amellyel hatékony tápanyag-beadagolási stratégiák valósíthatók meg a sejtek szükségletei alapján
A Raman-alapú monitorozó- és szabályozórendszer alkalmazásával kedvező tenyésztési körülményeket sikerült biztosítanom, aminek hatására hosszabb ideig és nagyobb sejtkoncentrációval fenntartható sejtkultúrát, illetve magasabb antitesttermelést értem el.
Várható impakt, további kutatás
A kutatómunkám során kifejlesztett Raman-spektroszkópia-alapú monitorozó- és szabályozórendszer lehetőséget nyújt az emlőssejtes tenyésztési folyamat azon kritikus paramétereinek valós idejű nyomon követésére és állandó értéken tartására, amelyek meghatározása jelenleg az iparban kizárólag mintavételezés útján offline és atline analitikai módszerekkel történik. A rendszer alkalmazásával a jövőben egyszerűbbé és gazdaságosabbá válhat az optimális tenyésztési körülmények biztosítása a sejtek számára, valamint a kívánt minőségű termék megfelelő mennyiségben történő előállítása. Emellett az általam bemutatott eredmények a gyógyszeripar számára jó iránymutatásul szolgálhatnak a hatóságok által egyre inkább megkövetelt, valós idejű mérésen alapuló folyamatkövetési és szabályozási, valamint automatizált rendszerek integrálására.
A kutatómunka jelentős része a Felsőoktatási és Ipari Együttműködési Központ (FIEK) projekt keretein belül valósult meg a Richter Gedeon Nyrt. támogatásával. Az együttműködés kiválóan tükrözi, hogy a tématerület iránt jelentős az ipari érdeklődés, és az eredmények hasznosítása a közeljövőben megvalósulhat.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája:
[I] Hirsch E, Pataki H, Domján J, Farkas A, Vass P, Fehér C, Barta Z, Nagy ZK, Marosi GJ, Csontos I. Inline noninvasive Raman monitoring and feedback control of glucose concentration during ethanol fermentation. Biotechnol Prog. 2019 Sep;35(5):e2848.
IF: 2.334 C: 15
[II] Domján J, Fricska A, Madarász L, Gyürkés M, Köte Á, Farkas A, Vass P, Fehér C, Horváth B, Könczöl K, Pataki H, Nagy ZK, Marosi GJ, Hirsch E. Raman-based dynamic feeding strategies using real-time glucose concentration monitoring system during adalimumab producing CHO cell cultivation. Biotechnol Prog. 2020 Nov;36(6):e3052.
IF: 2.513 C: 6
[III] Domján J, Vass P, Hirsch E, Szabó E, Pantea E, Andersen SK, Vigh T, Verreck G, Marosi G, Nagy ZK. Monoclonal antibody formulation manufactured by high-speed electrospinning. Int J Pharm. 2020 Dec 15;591:120042.
IF: 5.875 C: 6
[IV] Vass P, Pantea E, Domokos A, Hirsch E, Domján J, Németh Á, Molnár M, Fehér C, Andersen SK, Vigh T, Verreck G, Csontos I, Marosi G, Nagy ZK. Electrospun Solid Formulation of Anaerobic Gut Microbiome Bacteria. AAPS PharmSciTech. 2020 Jul 31;21(6):214.
IF: 3.246 C: 4
[V] Hirsch E, Pantea E, Vass P, Domján J, Molnár M, Suhajda Á, et al. Probiotic bacteria stabilized in orally dissolving nanofibers prepared by high-speed electrospinning. Food Bioprod Process. 2021;128:84–94.
IF: 4.32 C: 3
[VI] Domján J, Pantea E, Gyürkés M, Madarász L, Kozák D, Farkas A, Horváth B, Benkő Z, Nagy ZK, Marosi G, Hirsch E. Real-time amino acid, and glucose monitoring system for the automatic control of nutrient feeding in CHO cell culture using Raman spectroscopy. Biotechnol J. 2022 May;17(5):e2100395.
IF: 4.677 C: 0