|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Alkalmazott Biotechnológia és Élelmiszertudományi Tanszék
Témavezető: Dr. Vértessy G. Beáta
A DNS-felépítő bázisok mennyiségi meghatározása az antibiotikum rezisztencia kialakulásának modellezéséhez
A kutatási téma néhány soros bemutatása
A sejtek életképességének fenntartásában kiemelt jelentősége van a DNS-másolás pontosságának. A 4 DNS-építő bázist (guanin: dGTP, citozin: dCTP, timin: dTTP, adenin: dATP, gyűjtőnéven dNTP) a sejt finomhangolt egyensúlyban és mennyiségben tartja fenn. Ezek precíz egyensúlya hozzájárul a DNS pontos másolásához, és felborult szintjeik pedig DNS-hibák, azaz mutációk megjelenését teszik lehetővé1-3. Ezért a DNS-építő bázisok szintjeinek megváltozása nagyban hozzájárul az antibiotikum-rezisztencia kialakulásához is. Kutatásom során a DNS-építő bázisok mennyiségét vizsgálom bakteriális környezetben annak felderítésére, hogy miként alakul ki az antibiotikum-rezisztencia, ezáltal lehetővé téve egyre jobb antibiotikumok kifejlesztését.
A kutatóhely rövid bemutatása
Munkámat a BME VBK Alkalmazott Biotechnológia és Élelmiszertudományi Tanszéken végzem a Prof. Dr. Vértessy G. Beáta által vezetett Genom metabolizmus és DNS-hibajavítás kutatócsoportban. A kutatócsoport fő tevékenységei közé tartoznak a DNS-hibák és annak kijavításával foglalkozó enzimek vizsgálata, így a DNS megváltozásaként létrejövő antibiotikum-rezisztencia kialakulásának vizsgálata is.
A kutatás történetének, tágabb kontextusának bemutatása
Az antibiotikumok felfedezésével rengeteg bakteriális fertőzés vált kezelhetővé. A használatuk óta eltelt több mint fél évszázadban azonban az antibiotikumok túlzott és néha felesleges használata oda vezetett, hogy ma már kihívássá válik a kezelhető fertőzések terápiája, mivel az eleinte hatásos antibiotikumok egyre hatástalanabbá váltak a sejtek hozzászokása, az antibiotikum-rezisztencia megjelenése miatt. A tuberkulózist okozó Mycobacterium tuberculosis baktérium esetén sincs másképp: a hosszú kezelési idő, és a rengeteg antibiotikum együttes használata oda vezetett, hogy ma már egyszerre több drogra rezisztens (multirezisztens) törzsek jelentek meg4, és fenyegető veszélyt jelentenek az olyan törzsek, amelyek ellen a jelenleg fejlesztés alatt álló új szerek sem hatásosak (extrém drogrezisztens törzsek). Mivel a Mycobacterium nemzetség tagjai kizárólag pontmutációk sorozatával tudja kialakítani az antibiotikum-rezisztencia-géneket5, így kiváló modellorganizmus lehet az antibiotikum-rezisztencia kialakulásának vizsgálatára más olyan organizmusokkal szemben, amelyek akár a környezetükből, vagy más baktériumoktól is fel tudják venni a már kialakult rezisztenciagént. Kutatásom során tehát az antibiotikum-rezisztencia sejten belüli kialakulását vizsgálom Mycobacterium organizmuson, melynek célja egy olyan modell felállítása, amely képes előre jelezni az antibiotikum-rezisztencia várható kialakulását akár a fejlesztés alatt álló gyógyszerekre is, így lehetővé téve a minél jobb új gyógyszerek tervezését.
A kutatás célja, a megválaszolandó kérdések.
Mivel az antibiotikum-rezisztens baktériumtörzsek az antibiotikum nyomására, szelektívstressz-környezetben alakulnak ki, így szeretném megvizsgálni a Mycobacterium tuberculosis életciklusában jelentős stresszkörülményeket, amelyek esetlegesen hozzájárulhatnak a fokozott mutációs képességhez (1. ábra). Az említett baktérium cseppfertőzéssel, a levegőben terjed, és hosszú ideig megőrzi virulenciáját száraz körülmények között is. Ezért a környezetben jelen lévő stresszfaktorok a Mycobacterium tuberculosis számára az UV-sugárzás és az éhezés. A gazdaszervezetbe kerülve a baktérium az immunsejtek bekebelezésének esik áldozatul, itt azonban képes túlélni, és még szaporodni is, a nehéz körülmények ellenére. Ezért a betegekben a következő stresszfaktorok érik a baktériumot: tápanyagszegény környezet, alkiláció, és az immunrendszer által kifejtett reaktív oxigénszármazékok és nitrogéngyökök. Amennyiben a beteget gyógyszerrel kezelik, a használt első és második generációs antibiotikumok is stresszhatásként érik a baktériumot, melyek ellen küzdenie kell a túlélésért. Ezeket az azonosított stresszkörülményeket, amelyek mutátor hatással vannak a baktériumra, szisztematikusan megvizsgálom, hogy miként segítik elő az antibiotikum-rezisztencia kialakulását.
Az antibiotikumok általánosságban egy létfontosságú folyamatot akadályoznak meg a sejt működésében, így a velük szembeni rezisztencia ennek a feladatnak a kódolásáért felelős génben történő változásként jelenik meg. A gének megváltozásához nagyban hozzájárul a DNS-másolásakor rendelkezésre álló alapanyagok, a DNS-építő bázisok eltolódott mennyisége6, így célom ezek mennyiségi meghatározása külön-külön az összes említett stresszhatásra (1. ábra). Minden stresszkörülmény önállóan történő vizsgálatával láthatóvá válnak azok a tendenciák, amelyek abba az irányba kényszerítik a baktériumot, hogy az antibiotikumos környezethez alkalmazkodjon egy ellenálló génnel. A stresszkörülmények mutációs hatását is meghatározom a genomban történt mutációk azonosításával (1. ábra), ami a legmodernebb és erre a célra legalkalmasabb, új generációs teljesgenom-szekvenálással történik. Minden egyes stresszhatásra megvizsgálom, hogy a DNS-építő bázisok eltolódott mennyisége milyen típusú mutációkat generált, így egy olyan modellhez akarok adatokat szolgáltatni, amely képes egy esetlegesen fejlesztés alatt álló gyógyszerről előre jelezni az antibiotikum-rezisztencia kialakulásának a valószínűségét és várható idejét annak hatásmechanizmusa alapján.
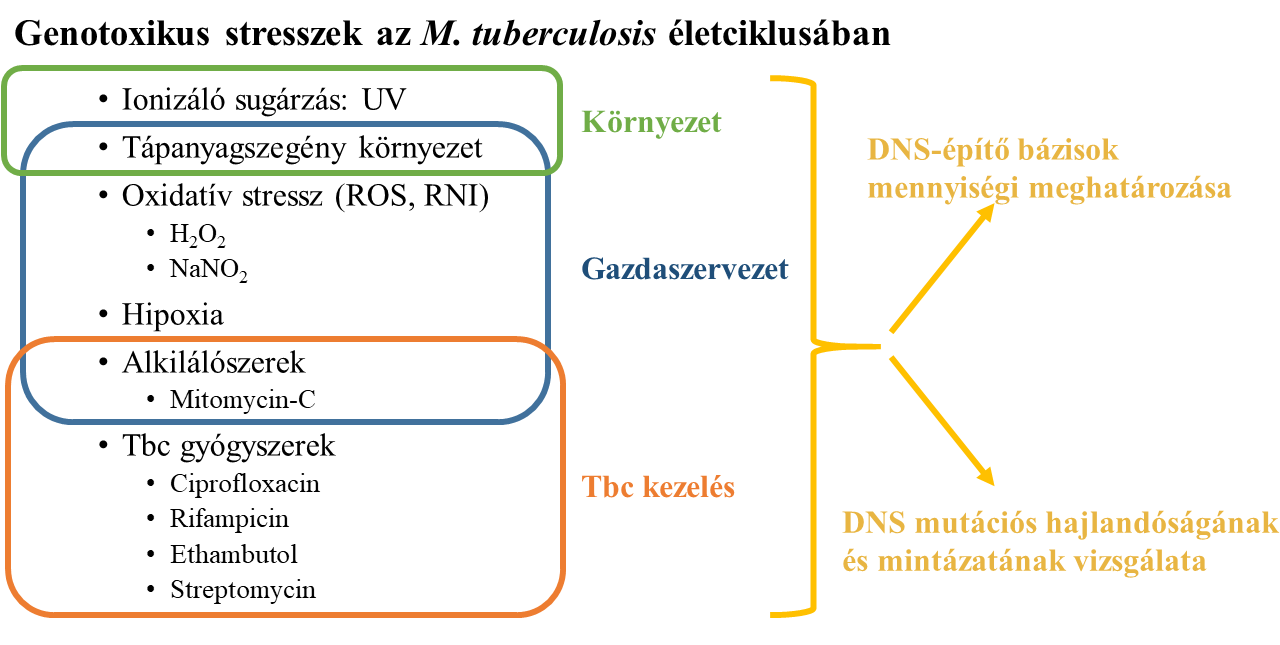
- ábra: A Mycobacterium tuberculosis életciklusában szerepet játszó stresszkörülmények hozzájárulnak a magas adaptációs képességéhez, így ezek pontosabb megvizsgálását tűztem ki célul.
Módszerek
A Mycobacterium DNS-építő bázisainak extrahálása
A Mycobacterium DNS-építő bázisainak kinyerésére metanolos extrakciót végzek7: a tápfolyadékban felnövesztett Mycobacterium-kultúrát centrifugálással összegyűjtöm, majd 1*109 mennyiségű sejtet 500 μl 60%-os metanolban szuszpendálok. A metanolba beoldódnak a kívánt kismolekulák, és a metanolban nem oldódó részeket (sejttörmelék, kicsapódott fehérje, DNS) pedig egy újabb centrifugálással távolítom el. Az így nyert tiszta metanolos extraktumot vákuumban beszárítom, és vízben feloldom.
DNS-építő bázisok mennyiségi meghatározása
A DNS-építő bázisok mennyiségi meghatározására laborunkban egy irodalmi módszert vettünk alapul8, melynek lényege, hogy DNS-szintézis során mérjük le az éppen beépülő alapanyagok mennyiségét, melyet fluoreszcencia-jelváltozás követ (2. ábra). Ezzel a módszerrel külön mérésben lehet meghatározni egy adott mintában lévő 4-féle DNS-építő bázis mennyiségét. A méréshez szükséges egy templát egyszálú DNS, ami mintául szolgál a kettős hélix DNS éppen szintetizálódó új szálához. A 2. ábra a timin mérésének példáján keresztül mutatja be a módszer működési elvét. A templát-DNS egyik végéhez teljesen illeszkedő komplementer primer DNS kapcsolódik, a DNS-szintézis a primer végétől indulhat el. A DNS-szintézist a DNS-polimeráz enzim végzi, ez az enzim az élőlények sejtosztódásakor ugyanezt a feladatot látja el: egy megadott DNS-mintát kiegészít a másik, komplementer DNS-szállal. Ehhez a készülő DNS-szálhoz szükségesek az alapanyagok, amelyeket mérni szeretnénk. A DNS-szál kiegészítéséhez az adott példában 6 timinre van szükség, és mikor megtörtént mindegyiknek a beépítése, a Taq DNS-polimeráz enzim eljut a templát másik végéhez, amelyre egy fluoreszcensen jelölt próba hibridizál. A fluoreszcenciajel a próbán gátolva van, így nem ad jelet. A DNS-polimeráz enzim azonban képes a próbát kémiailag elhasítani, így felszabadul a fluoreszcenciajel (jelen esetben FAM), mely a térben távol kerül a jelet kioltó gátló molekuláktól (ZEN, IBFQ), és ezáltal jelet generál. A bemutatott példán a fluoreszcenciajel arányos lesz 6 timin mennyiségével. A méréshez egy megfelelő tartományban felvett kalibrációs egyenes alapján meghatározhatóvá válik a minták timin tartalma. A módszer eredeti, végpontfluoreszcencia-mérésen alapuló formájában biológiai mintákon nem volt használható a mintamátrix befolyásoló hatása miatt. Ezért kollégáimmal ezt a módszert továbbfejlesztettük, és a reakció teljes idejében felvett fluoreszcenciaadatokból kinetikai elemzéssel határozzuk meg a beépült DNS-építő bázis mennyiségetS1. Az átdolgozott módszerhez egy kiértékelő szoftvert is készítettem, mely nagyban megkönnyíti és felgyorsítja az eredmények értékelését.
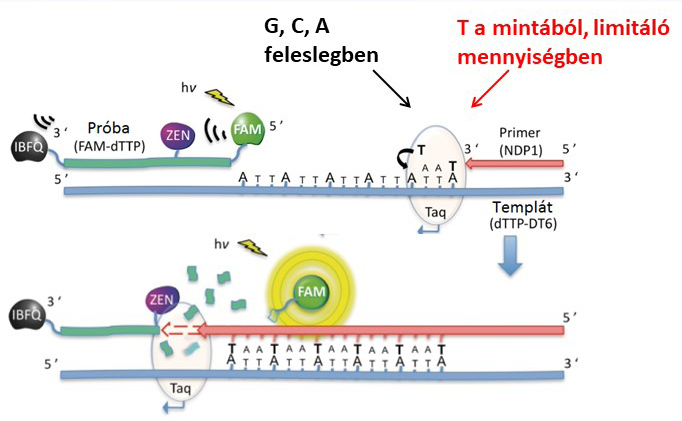
2. ábra: Fluoreszcens módszer a DNS-építő bázisok mennyiségi meghatározására, a T mérés példáján
A Mycobacterium genomi DNS-ének mutációs analízise
A Mycobacterium teljes genomjának szekvenálására egy erre szakosodott céget bíztunk meg, a kapott eredmény bioinformatikai kiértékelését viszont magam végzem el. A genom szekvenálásából adódó “read”-eket a referencia genomhoz illesztve megkereshetők azok a régiók, ahol nem pontos a bázisok illeszkedése: a variánsok összegyűjtésével megkapható a mutációs mintázat.
Eddigi eredmények
Kutatásom során megállapítottam, hogy a Mycobacteriumon végzett stressz kezelések tényleg változásokat indukálnak a DNS-építő bázisok mennyiségében, és a baktérium mutációs hajlandóságában is. A kapott változások pedig kezelésenként eltérőek (3. ábra): míg ciprofloxacin, rifampicin és sztreptomicin antibiotikumok hatására a DNS-építő bázisok készletének megnövekedett mennyisége tapasztalható, illetőleg ezek aránya egymáshoz képest felborult, a tápanyagszegény környezet vagy például a reaktív nitrogénszármazékokat reprezentáló NaNO2-kezelés hatására ezek szintje csökken, illetőleg nem változik. Érdekes módon UV-besugárzás hatására a sejtek DNS-építő bázisainak mennyisége nagyságrendnyi növekedést mutatott, és ugyanez jellemző az oxidatív stresszt reprezentáló H2O2-kezelésre is. Ugyanakkor a timin (dTTP) szintézisét gátló 5-fluorouracil (5-FU) szelektíven csökkentette a sejtbeli dTTP mennyiségét, míg az ehhez szükséges prekurzor citozin szintje magasabb maradt. Ezekkel az eredményekkel összhangban van a stressz hatására indukálódott mutációk minősége és mennyisége is (4. ábra). Az 5-FU esetén a C≡G bázispár → A=T mutációs gyakorisága csökkent, mely a megnövekedett citozinszinttel van összhangban, és a T=A bázispár → G≡C párra történő megnövekedett hajlandósága szintén az alacsonyabb adeninszint és magasabb citozinszint arányából következik. Ehhez képest a ciprofloxacin, mely hatását tekintve a DNS letekeredését akadályozza, megemelkedett inzerciós és deléciós mutációkat okoz. A sztreptomicinkezelés hatására a mutációs gyakoriság nem nőtt, sőt ellenkezőleg: kevesebb C≡G → A=T mutáció és kevesebb deléció történt a nem kezelt sejtekhez képest. A H2O2-kezelés hatására a C≡G → T=A, T=A → A=T és C≡G → G≡C bázispárcserék történtek meg emelkedett számban, melyből az utóbbit egyértelműen az oxidált guaninbázis továbboxidációja okoz9.
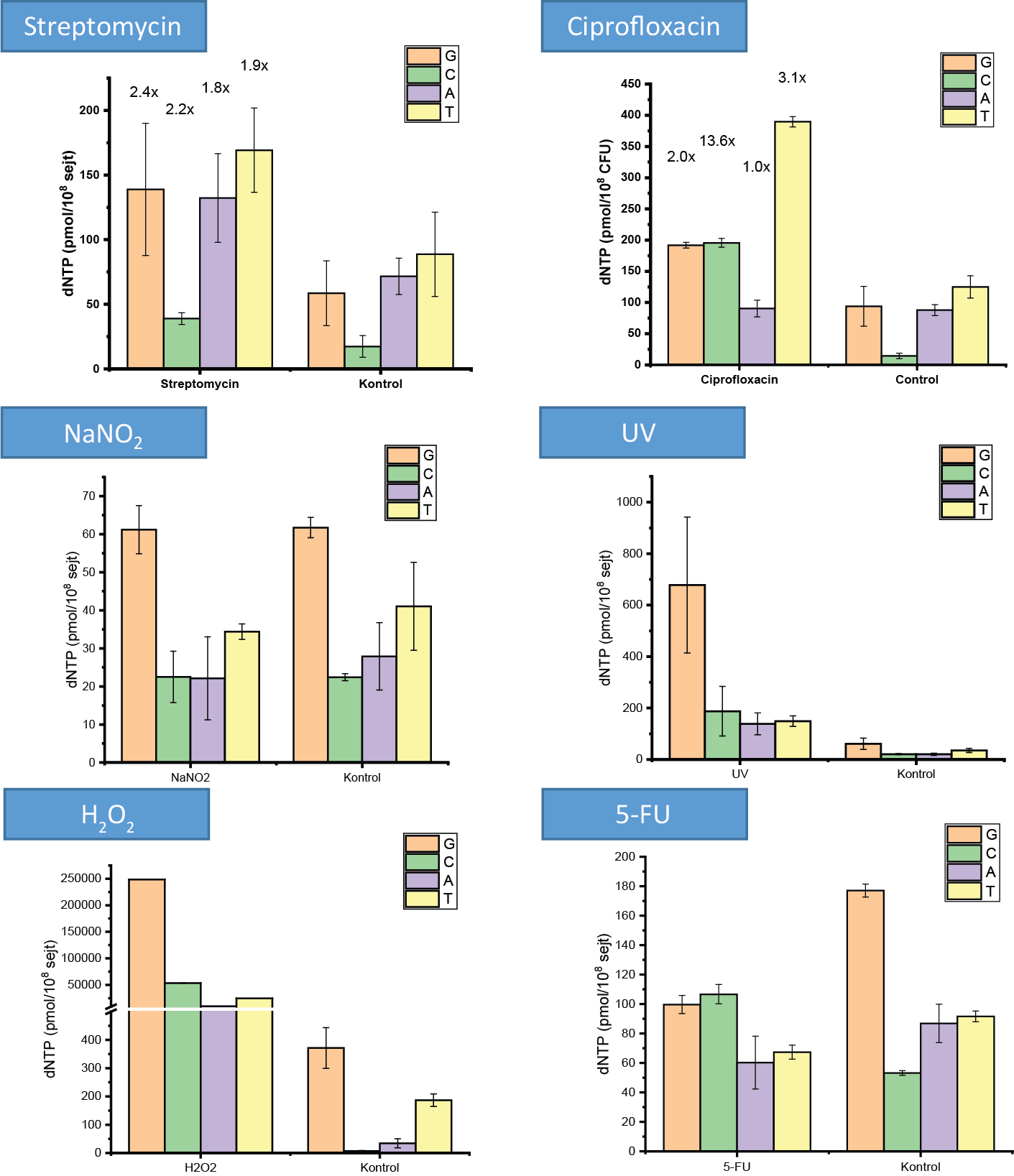
3. ábra: a DNS-építő bázisok mennyisége különféle stressz kezelés hatására
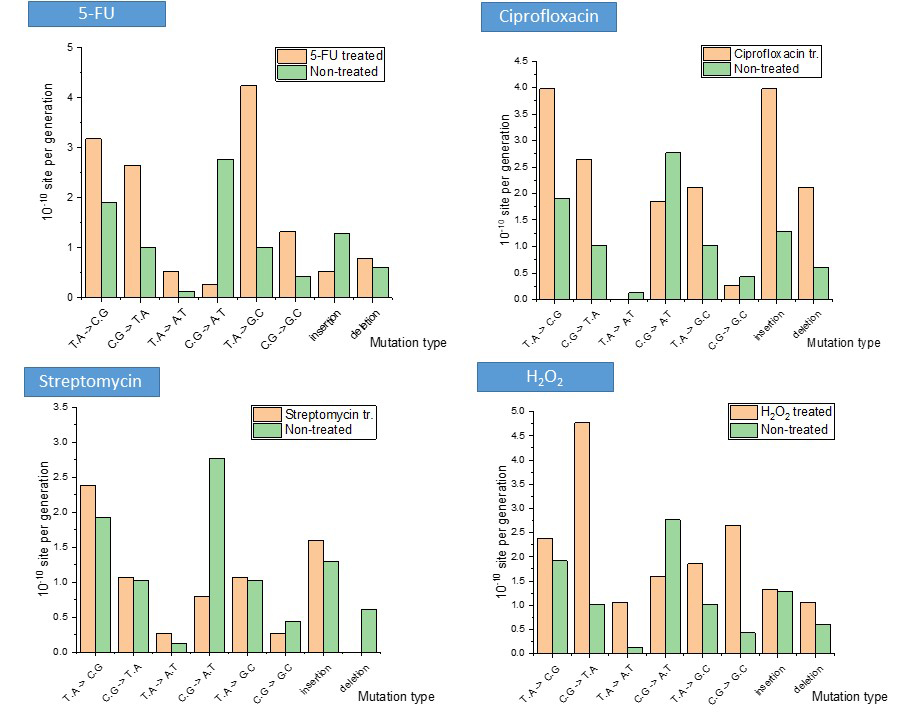
4. ábra: a mutációs mintázat és hajlandóság változása az alkalmazott stresszhatások esetén
Várható impakt, további kutatás
PhD-munkám részeként a Mycobacteriumon végzett kutatásaimból 3 nemzetközi referált publikáció (S2-S4) és egy magyar publikáció (S5) jelent meg, ami várhatóan tovább bővül 3 készülő publikációval. A Mycobacteriumok antibiotikum-rezisztenciájának kialakulásáról végzett kutatásommal nemcsak a fertőző Mycobacterium tuberculosis hatékonyabb kezelését segíthetem elő, hanem az számos egyéb bakteriális fertőzés esetén is hasznos lehet. Kutatási eredményeimet kollégáim beépítik az általuk elkészített modellbe, mely a Mycobacterium tuberculosis baktérium legfontosabb életfolyamatait tartalmazza, így lehetővé válik azon célpontok (pl. enzimek) azonosítása, melyek a baktérium gyenge pontjai. Az ilyen célpontokra tervezett antibiotikumokkal várhatóan nem, vagy csak nagyon ritkán alakul majd ki rezisztencia, amennyiben az adott célpont feladata kulcsfontosságú a sejtműködés szempontjából.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája:
S1. J. E. Szabó*, É. V. Surányi*, B. Mébold, T. Trombitás, M. Cserepes, and J. Tóth, “A tool for the precise quantitation of deoxyribonucleoside triphosphates from biological samples”. Manuscript under submission (2019).
*first authors
S2. R. Hirmondó*, A. Lopata*, É. V. Surányi*, B. Vértessy G., and J. Tóth, “Differential control of dNTP biosynthesis and genome integrity maintenance by the dUTPase superfamily enzymes,” Sci. Rep.,7 (2017).
*first authors
S3. É. Surányi et al., “Exploiting a Phage-Bacterium Interaction System as a Molecular Switch to Decipher Macromolecular Interactions in the Living Cell,” Viruses, 10, 168, (2018).
S4. A. Benedek, F. Temesváry-Kis, T. Khatanbaatar, I. Leveles, É. V. Surányi, J. E. Szabó, L. Wunderlich, B. G. Vértessy, “The Role of a Key Amino Acid Position in Species-Specific Proteinaceous dUTPase Inhibition.” Biomolecules 9, 221 (2019).
S5. É. V. Surányi, R. Hírmondó, K. Nyíri, J. Tóth, and G. B. Vértessy, „Egy új molekuláris kapcsolórendszer létrehozása élő sejten belüli makromolekuláris felismerés megfejtésére”, XV. PEME Konf. kiadvány, II, 130–135, (2017).
Nem kapcsolódó publikációk listája:
S6. N. Z. Kiss, É. Böttger, L. Drahos, and G. Keglevich, “Microwave-Assisted Direct Esterification of Cyclic Phosphinic Acids,” Heteroat. Chem., 24, 283–288 (2013).
S7. N. Z. Kiss, Z. Mucsi, É. Böttger, L. Drahos, and G. Keglevich, “A Three-Step Conversion of Phenyl-1 H -phosphinic Acid to Dialkyl Phenylphosphonates Including Two Microwave-Assisted Direct Esterification Steps,” Curr. Org. Synth., 11, 767–772 (2014).
S8. N. Z. Kiss, Z. Mucsi, Z. Rádai, É. V. Böttger, and G. Keglevich, “The synthesis and potential use of cyclic phosphinic acid derivatives,” Phosphorus. Sulfur. Silicon Relat. Elem., 190, 668–671 (2015).
Linkgyűjtemény:
www.biostruct.org
http://www.biostruct.org/index.php/research/projects#dNTP
https://hu.wikipedia.org/wiki/Mycobacterium_tuberculosis
https://en.wikipedia.org/wiki/Reactive_oxygen_species
https://en.wikipedia.org/wiki/Reactive_nitrogen_species
https://en.wikipedia.org/wiki/Whole_genome_sequencing
http://nucleotidy.enzim.ttk.mta.hu/
Hivatkozások listája:
- D. Ahluwalia, R. J. Bienstock, and R. M. Schaaper, “Novel mutator mutants of E. coli nrdAB ribonucleotide reductase: insight into allosteric regulation and control of mutation rates.,” DNA Repair (Amst)., 11,480–487 (2012).
- J. a Hollenbaugh et al., “dNTP pool modulation dynamics by SAMHD1 protein in monocyte-derived macrophages.,” Retrovirology, 11, 63, (2014).
- P. Y. Ke, Y. Y. Kuo, C. M. Hu, and Z. F. Chang, “Control of dTTP pool size by anaphase promoting complex/cyclosome is essential for the maintenance of genetic stability,” Genes Dev., 19, 1920–1933 (2005).
- E. A. Kendall, A. S. Azman, F. G. Cobelens, and D. W. Dowdy, “MDR-TB treatment as prevention: The projected population-level impact of expanded treatment for multidrug-resistant tuberculosis,” PLoS One, 12, p. E0172748 (2017).
- M. Mcgrath, N. C. Gey van pittius, P. D. Van helden, R. M. Warren, and D. F. Warner, “Mutation rate and the emergence of drug resistance in Mycobacterium tuberculosis,” J. Antimicrob. Chemother., 69, 292–302 (2014).
- S. Gon, R. Napolitano, W. Rocha, S. Coulon, and R. P. Fuchs, “Increase in dNTP pool size during the DNA damage response plays a key role in spontaneous and induced-mutagenesis in Escherichia coli.,” Proc. Natl. Acad. Sci. U. S. A., 108, 19311–6, (2011).
- R. Hirmondó et al., “Cross-species inhibition of dUTPase via the Staphylococcal Stl protein perturbs dNTP pool and colony formation in Mycobacterium,” DNA Repair (Amst)., 30, 21–27 (2015).
- Wilson, P. M. et al. “A novel fluorescence-based assay for the rapid detection and quantification of cellular deoxyribonucleoside triphosphates”. Nucleic Acids Res. 39, 1–15 (2011).
- K. Kino and H. Sugiyama, “Possible cause of G-C-->C-G transversion mutation by guanine oxidation product, imidazolone.,” Chem. Biol., 8, 369–78 (2001).
