|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Hazai László
Daganatellenes hatású Vinca alkaloidok szintézise
A kutatási téma néhány soros bemutatása
Kutatásunk egy természetes vegyületcsalád köré csoportosul, ezek a rózsás meténg (Catharanthus roseus) nevű növényből izolálható ún. Vinca alkaloidok [1,2].

1. ábra. A Vinca alkaloidok forrása: rózsás meténg (Catharanthus roseus)
Az elnevezés régi, hagyományos hatóanyagokat foglal magába, amelyeknek jobb alternatíva híján a mai napig van létjogosultságuk bizonyos ráktípusok esetén (pl. különböző limfómák, leukémia). A daganatos sejtek egészséges sejtekből keletkeznek. Valamilyen rákkeltő tényező hatására (kémiai anyag, sugárzás, vírus vagy napfény) az egészséges sejtek örökítőanyaga megváltozik, ami a kontrollálatlan jelátviteli folyamatok révén rákos elfajulás felé tereli a sejtet (féktelen szaporodás). Kutatócsoportunk célja olyan új származékok előállítása az említett vegyületcsaládon belül, amelyek hatásosabbak, szelektívebbek, vagy éppen kevésbé toxikusak elődeiknél, illetve a jelenleg piacon lévő készítményeknél. Alapvetően tehát a Vinca alkaloidok fejlesztésével és új származékok előállításával foglalkozunk. Úgy gondoljuk, hogy a téma korszerű, hiszen a rák, mint komoly betegség gyógyítására irányul. Ugyanakkor kihívást is jelent, mivel a Vinca alkaloidokkal kapcsolatos munka egy kémiailag nehezen művelhető terület.
A kutatóhely rövid bemutatása
A Szerves Kémia és Technológia Tanszék Alkaloidkémiai Kutatócsoportjában daganatellenes hatású szerves anyagok szintézisével foglalkozunk Dr. Hazai László egyetemi magántanár vezetésével. Munkánkban a preparatív szerves kémia összekapcsolódik a gyógyszerkémiával és a szerkezet-hatás összefüggések vizsgálatával. Ez az összetett munkafolyamat adja a terület szépségét is, hiszen nem csupán gyógyszerhatóanyagok kémiai fejlesztésével foglalkozunk, hanem vizsgáljuk új vegyületeink biológiai aktivitását is. Nagy múltra visszatekintő kutatóhelyünk híres professzora volt Dr. Szántay Csaba (1928-2016) vegyészmérnök, a Magyar Tudományos Akadémia rendes tagja. Neki köszönhető a vinpocetin szintetikus előállítása és ipari szintézisének kidolgozása. A hatóanyag később Cavinton® néven került forgalomba, mint agyi vérkeringés-fokozó, ezáltal memória-serkentő szer. A készítmény a hazai gyógyszeripar egyik napjainkban is népszerű terméke, amelyet a Richter Gedeon Nyrt. 1978 óta gyárt.

2. ábra. Az alkaloidkémiai kutatócsoport korábbi vezetője, Dr. Szántay Csaba (1928-2016) és életművének egyik fő lenyomata: a vinpocetin, a Cavinton® hatóanyaga
A kutatás történetének, tágabb kontextusának bemutatása
Az alkaloidok definíciószerűen nitrogéntartalmú, többnyire heterociklusos természetes anyagok, amelyek bázikus tulajdonságuk mellett erős élettani hatással is rendelkeznek. Forrásaik leggyakrabban különböző növények. Nincsen egységes szerkezetük, a vegyületcsaládba sorolható többek között a morfin, nikotin, atropin, kinin, papaverin, illetve a kokain is. A Vinca alkaloidokat az 1950-es években izolálta először Robert Noble és Charles Beer a már említett, Madagaszkáron őshonos rózsameténgből [3]. A tumorellenes hatással rendelkező, dimer szerkezetű vinblasztin (1) és vinkrisztin (2) (összetett struktúrájukban csupán egyetlen funkciós csoport eltérése jelenti a különbséget) a katarantin (3) és a vindolin (4) nevű alegységek (monomerek) összekapcsolódásával jönnek létre.
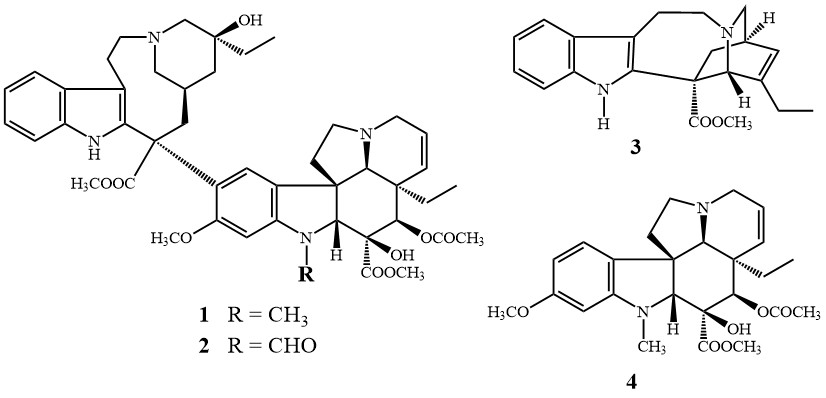
3. ábra. A Vinca alkaloidok közé tartozó vinblasztin (1), vinkrisztin (2), katarantin (3) illetve vindolin (4) szerkezete.
Ez utóbbiak jóval nagyobb mennyiségben vannak jelen a növényben, mint a dimerek (0.005%), azonban önmagukban nincs rákellenes hatásuk. Ezért a gyógyszeripar és a kutatók a Vinca alkaloidok iránti fokozatosan gyarapodó érdeklődést és keresletet nem csupán a növényből történő izolálással, hanem a monomerek szintetikus úton történő összekapcsolásával, sőt totálszintézissel elégítették ki. Érdekesség, hogy a vegyületcsaládot először a diabétesz gyógyításának reményében vizsgálták, és csak az állatkísérletek során figyeltek fel a fehérvérsejtszám- illetve csontvelőállomány-csökkenést okozó hatásukra.
4. ábra. Vinblasztin (1) és vinkrisztin (2) hatóanyagot tartalmazó gyógyszerkészítmények
A Vinca alkaloidok citotoxikus tulajdonsága a mikrotubulusok működésének gátlásán keresztül valósul meg [4]. Ezek a csőszerű, eukarióta sejtvázalkotók fenntartják a sejt belső rendezettségét és elősegítik a kromoszómák szétválását a sejtosztódás során. A mikrotubulusok gátlásával a hatóanyagok végső soron megakasztják a mitózist, ami sejthalálhoz vezet. Ezért is nevezik a Vinca alkaloidokat tubulinmérgeknek. A vegyületcsaládot szulfát-sóik formájában, intravénás infúzióban alkalmazzák, mivel rossz vízoldhatóságuk miatt a tápcsatornából gyenge a felszívódásuk. Leggyakrabban kombinációs készítmények részeként használatosak. Sajnos igen toxikus vegyületek, komoly mellékhatásaik vannak, emiatt a klinikai alkalmazhatóságuk korlátozott. További problémát jelent a multidrog-rezisztencia (MDR) jelensége, amely a sejtek önvédelmi reakciója a testidegen anyagokkal (xenobiotikumokkal) szemben. A védekezés elsődleges módja a sejtből kifelé irányuló (efflux) transzport, amely során az e célra specializálódott P-glikoprotein (P-gp) nevű transzmembrán-fehérje a nemkívánatos anyagokat ATP (energia) felhasználásával kijuttatja a sejtből. Sokszor a P-gp mediált efflux-transzport akadályozza a gyógyszermolekulák hatásának kialakulását (gyógyszer-rezisztencia), így van ez többek között a Vinca alkaloidok esetében is.
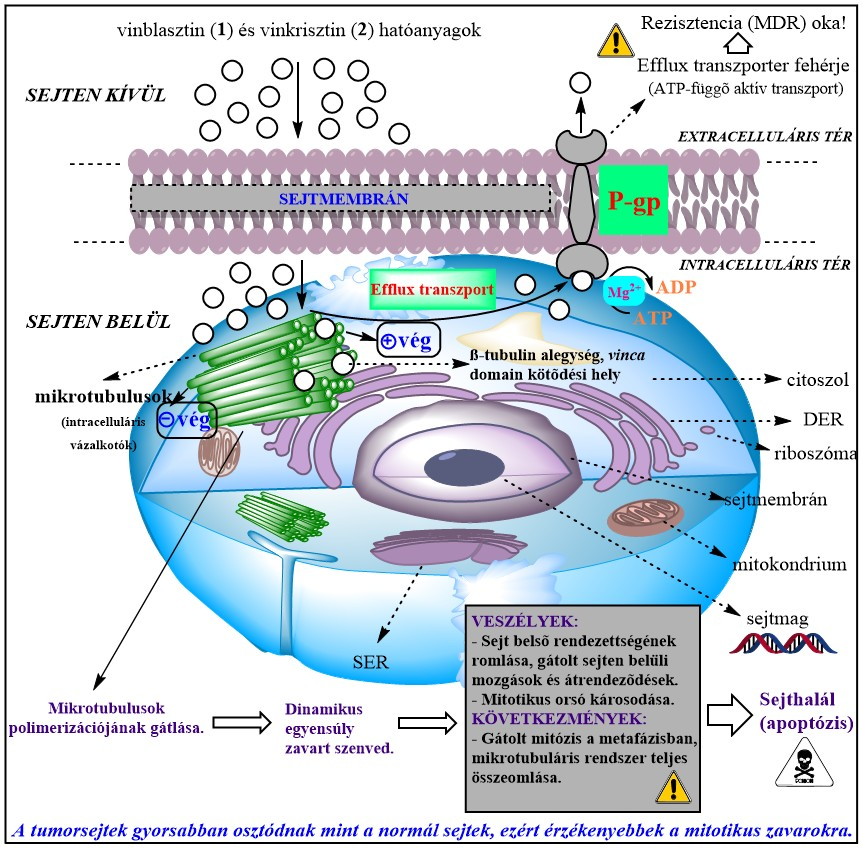
5. ábra. A Vinca alkaloidok hatásmechanizmusa a mikrotubuláris rendszer gátlásán keresztül. P-gp: foszfo-glikoprotein. MDR: multidrog-rezisztencia. DER: durva felületű endoplazmás retikulum. SER: sima felületű endoplazmás retikulum
A kutatás célja, a megválaszolandó kérdések.
Kutatócsoportunkban jelenleg különböző típusú hibridmolekulák szintézisével foglalkozunk. A gyógyszerkémiai hibridizációval lehetségessé válik az ún. kettős vagy többszörös hatású anyagok tervezése. A hibridek előállítása a modern gyógyszerkutatásban is elterjedt eljárás [5,6], az általános cél a hatékonyság növelése és/vagy a mellékhatások redukálása azáltal, hogy kettő vagy több farmakofór egységet alakítunk ki egy molekulán belül, így a kapott vegyületek akár többféle receptorral is interakcióba léphetnek, vagyis több előnyös biológiai hatásuk lehet. A farmakofór egy olyan elkülöníthető, biológiai hatás-hordozó strukturális egység (meghatározott térbeli szerkezettel) a molekulán belül, amely gyógyszerszerű tulajdonsággal rendelkezik, és amelyet egy vagy több receptor képes felismerni. A hibrid szerkezetekben a kapcsolat kovalens kötés révén valósul meg. Kutatócsoportunk korábban már előállított aminosavakkal [7], illetve szteroidokkal kapcsolt Vinca-származékokat. Az aminosavakkal történő kapcsolások nagy előnye, hogy hordozó peptidekhez kötve (pl. oktaarginin) közvetlenül képesek a sejtbe jutni, ezáltal célzottabb terápiát tesznek lehetővé, és így csökkenhetnek a már említett komoly mellékhatások. A szteroid vektor pedig elősegítheti a hatóanyag könnyebb bejutását (internalizációját) a sejtbe.
Módszerek
Munkánk aktuális fázisában szintetikus farmakofórok hatását vizsgáljuk, így kísérletet tettünk morfolinnal, piperazinnal, N-metilpiperazinal illetve trifenilfoszfinnal történő kapcsolások megvalósítására [8,9].
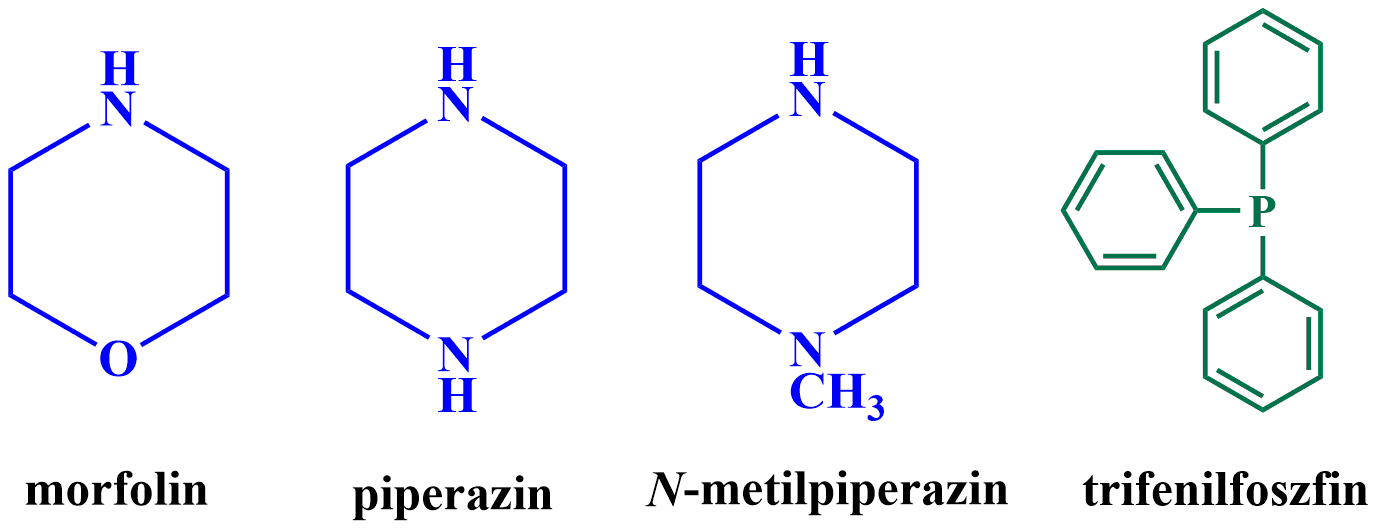
6. ábra. A Vinca alkaloidokkal kapcsolni kívánt szintetikus farmakofór egységek szerkezeti képlete
Kiindulási anyagként a vindolint (4) használtuk, amely önmagában nem citotoxikus, viszont információt adhat a dimer alkaloidok várható kémiai és biológiai viselkedéséről. Valószínűsítettük azt is, hogy hibrid formában a monomernek akár daganatellenes hatása is lehet.
Alkalmazott módszereink alapvetően a szerves kémiai preparatív munkavégzés során használt ismert technikákat foglalják magukba a megfelelő biztonságtechnikai megfontolások betartásával. Vegyületeink tisztítására általában preparatív vékonyréteg-kromatográfiát használunk. A szerkezetazonosítás mágneses magrezonancia (NMR) spektroszkópiával és tömegspektrometriával (MS) történik. Az NMR- és MS-spektrumok felvételét és értékelését a Richter Gedeon Nyrt. Szerkezetkutatási Osztály munkatársai végzik.
Eddigi eredmények
A hibridek szintézisénél első lépésben minden esetben arra volt szükség, hogy a vindolinból (4) észter-hidrolízissel 17-dezacetilvindolint állítsunk elő, ezután a vegyületet már el tudtuk látni különböző lánchosszúságú kapcsolókomponensekkel (5,6). Feltételeztük ugyanis, hogy a linker lánchosszúsága is befolyásolhatja a szintetizálandó hibrid daganatellenes hatását. Először a morfolinnal történő kapcsolásokat vizsgáltuk. A szintetikus munka sikeres volt, azonban a biológiai vizsgálatok során kiderült, hogy ennek a származéknak nem volt számottevő antiproliferatív hatása. Ezután a piperazinnal történő kapcsolásokat tanulmányoztuk. A reakció a morfolinnal végzett kapcsolási kísérlethez igen hasonlóan zajlott. Ebben az esetben egy dimer termékhez jutottunk, vagyis a piperazin mindkét oldalára (N atomjára) kötődött 1-1 linkerrel ellátott vindolin-egység. A csak a piperazin egyik oldalán funkcionalizált származék előállítását N-metilpiperazin alkalmazásával sikerült megoldani. Utóbbi két származék biológiai hatásvizsgálata jelenleg is folyamatban van. Végül trifenilfoszfinnal kapcsolt vindolinszármazékok előállításával foglalkoztunk. Szerettünk volna ugyanis foszfortartalmú strukturális egységeket is kipróbálni, mint lehetséges kapcsolókomponenseket, és a trifenilfoszfintól azt reméltük, hogy javíthatja a sejtmembrán-permeabilitást, illetve elősegítheti a hatóanyag akkumulációját a sejten belül. A szakirodalomból [9] ráadásul az is kiderült, hogy a trifenilfoszfinnak önmagában is van citotoxikus aktivitása (citotoxikus = a sejt pusztulását okozó; citosztatikus = sejt szaporodást gátló). Kapcsolódó kísérleteink során az 5-ös illetve 6-os jelű, linkerrel ellátott vindolinszármazékokból kiindulva, abszolutizált (vízmentes) acetonitril oldószerben dolgozva, argon atmoszféra alatt, a reakcióelegyet forralva (refluxáltatva) sikerült előállítanunk kétféle foszfónium-sót (7,8).
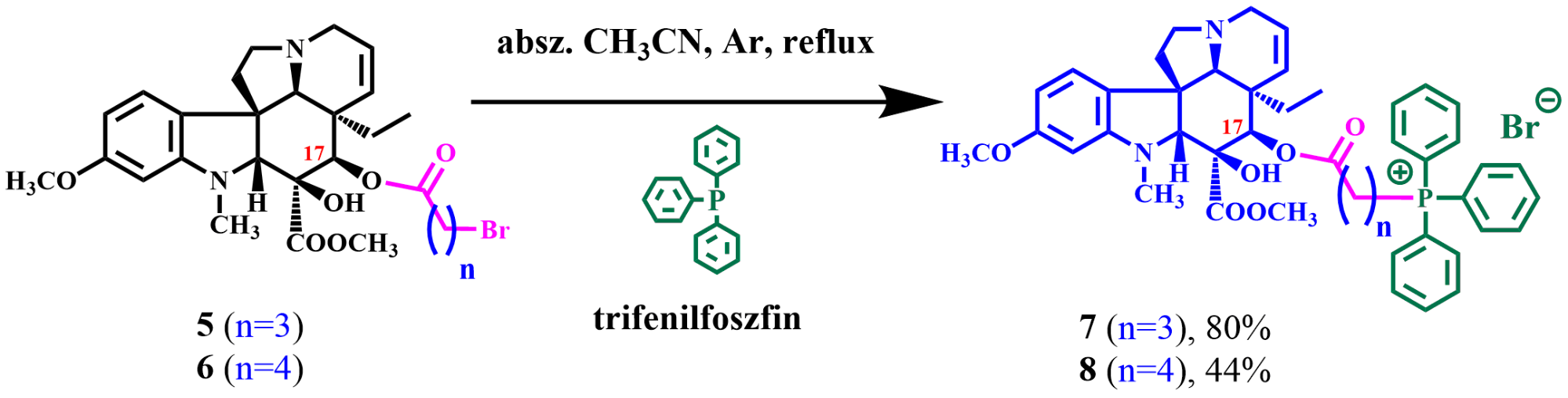
7. ábra. Linkerrel ellátott Vinca-származékok (5,6) kapcsolása trifenilfoszfinnal és a kapott foszfónium-sók (7,8)
Négy mintánk biológiai vizsgálata lezárult az amerikai Nemzeti Egészségügyi Intézetekben (National Institutes of Health, rövidítve NIH), ahol 9 gyakori tumortípus 60 különböző sejtvonalán tesztelték vegyületeink citotoxikus aktivitását in vitro. Az első vizsgálatok során kapott eredmények azt mutatták, hogy a csak linkerrel (4-brómbutánsavval) ellátott vindolin hatástalan maradt, továbbá a morfolinnal kapcsolt származék sem volt számottevően effektív. Azonban a trifenilfoszfinnal kapcsolt hibridek (7,8) olyan jó eredményeket mutattak, hogy az egydózisú vizsgálatok után a NIH további tesztelésnek vetette őket alá. Ezek voltak az ún. ötdózisú (öt különböző koncentrációjú) vizsgálatok, amelyek többek között GI50 (growth inhibition) értékeket szolgáltattak (sejtnövekedést 50%-ban gátló koncentráció), amely a hagyományosan használt IC50 értékeknek egy újraértelmezett (korrigált) változata [10]. A GI50 értékek alapján a trifenilfoszfin-tartalmú hibridek a vindolinnál (4) jóval hatásosabbnak bizonyultak, viszont a vinblasztin (1) rákellenes aktivitását nem érték el. Mindez azt sugallja, hogy a Vinca alkaloid monomerek is válhatnak potenciális rákellenes szerekké hibrid formában.
Várható impakt, további kutatás
Aktuális projektünkben különböző farmakofór-hibridizációs kísérletekkel foglalkoztunk és sikeresen állítottunk elő morfolinnal, piperazinnal, N-metilpiperazinnal, illetve trifenilfoszfinnal kapcsolt vindolin-hibrideket. Ezek közül a trifenilfoszfint tartalmazó származékok (7,8) jelentős antiproliferatív hatással rendelkeztek. A jövőben továbbra is különböző hibridek előállítását tervezzük, és az ígéretes vegyületek esetén szeretnénk megvizsgálni az analóg vinblasztin/vinkrisztin hibridek előállíthatóságát és tumorellenes hatását is. Továbbá szeretnénk erősíteni az együttműködésünket Dr. Hudecz Ferencz (ELTE) és Dr. Hunyadi Attila (SZTE) kutatócsoportjaival is, a biológiai vizsgálatok kiterjesztése érdekében.
Kapcsolódó saját publikációk listája
1) Natural compounds containing a condensed cyclopropane ring. Natural and synthetic aspects. Current Organic Chemistry, 2014, 18, 2037–2042. IF: 2.193
https://doi.org/10.2174/1385272819666140721190257
Authors: Keglevich, P.; Keglevich, A.; Hazai, L.; Kalaus, G.; and Szántay, C.
2) Anomalous Products in the Halogenation Reactions of Vinca Alkaloids. Current Organic Chemistry, 2016, 20, 2639–2646. IF: 2.193
https://doi.org/10.2174/1385272820666160617080202
Authors: Keglevich, A.; Hegedűs, L.; Péter, L.; Gyenese, J.; Szántay, C.Jr.; Dubrovay, Z.; Dékány, M.; Szigetvári, Á.; Martins ,A.; Molnár, J.; Hunyadi, A.; Keglevich, P. and Hazai, L.
3) The effect of conjugation on antitumor activity of vindoline derivatives with octaarginine, a cell‐penetrating peptide. Journal of Peptide Science, 2018, 24, 3118. IF: 1.969
https://doi.org/10.1002/psc.3118
Authors: Bánóczi, Z.; Keglevich, A.; Szabó,I.; Ranđelović, I.; Hegedüs, Z.; Regenbach, F.L.; Keglevich, P.; Lengyel, Z.; Gorka–Kereskényi, Á.; Dubrovay, Z.; Háda, V.; Szigetvári, Á.; Szántay, C.Jr.; Hazai, L.; Tóvári, J. and Hudecz, F.
4) Attempted Synthesis of Vinca Alkaloids Condensed With Three-Membered Rings. Molecules, 2018, 23, 2574. IF: 3.098
https://doi.org/10.3390/molecules23102574
Authors: Keglevich, A.; Mayer, S.; Pápai, R.; Szigetvári, Á.; Sánta, Z; Dékány, M.; Szántay C.Jr.; Keglevich, P. and Hazai, L.
5) A mainly NMR-based structure elucidation of a surprising vindoline trimer with the aid of non-uniform sampled 1H-13C HSQC and HMBC spectra. Structural Chemistry, 2019, 30, 795–804. IF: 2.019
https://doi.org/10.1007/s11224-018-1267-1
Authors: Szigetvári, Á.; Keglevich, A.; Keglevich, P.; Dékány, M.; Hazai, L. and Szántay, C.Jr.
6) Synthesis of Vinca alkaloid – triphenylphosphine derivatives having potential antitumor effect. Phosphorus, Sulfur, and Silicon and the Related Elements, 2019, 194, 606–609. IF: 0.674
https://doi.org/10.1080/10426507.2018.1550780
Authors: Keglevich, A.; Szigetvári, Á.; Dékány, M.; Szántay, C.Jr.; Keglevich, P. and Hazai, L.
Elfogadott, még meg nem jelent publikációk
7) Synthesis and in vitro Antitumor Effect of New Vindoline Derivatives Coupled with Triphenylphosphine. Current Organic Chemistry, 2019, 23, 1-7. IF: 2.193
Authors: Keglevich, A.; Szigetvári, Á.; Dékány, M.; Szántay, C.Jr.; Keglevich, P. and Hazai, L.
8) Synthesis and in vitro Antitumor Effect of New Vindoline-Steroid Hybrids. Current Organic Chemistry, 2019, 23, 1–9. IF: 2.193
Authors: Keglevich, A.; Zsiros, V.; Keglevich, P.; Szigetvári, Á.; Dékány, M.; Szántay, C.Jr.; Mernyák, E.; Wölfling, J. and Hazai, L.
Elfogadott, még meg nem jelent rövid közlések
9) Vinca alkaloidok és rákkutatás (ismeretterjesztő cikkpályázat, III. helyezés, 2019). Élet és Tudomány. IF: -
Authors: Keglevich, A.
Linkgyűjtemény.
preparatív vékonyréteg-kromatográfia
mágneses magrezonancia (NMR) spektroszkópia
Hivatkozások listája
[1] Arora, R.; Malhotra, P.; Mathur, Ajay K.; Mathur, Archna; Govil, C.M.; Ahuja, P.S. Anticancer Alkaloids of Catharanthus roseus: Transition from Traditional to Modern Medicine. Herbal Medicine: A Cancer Chemopreventive and Therapeutic Perspective, 2009, 21, 292–310.
[2] Mukhtar, E.; Adhami, V.M.; Mukhtar, H. Targeting Microtubules by Natural Agents for Cancer Therapy. Mol. Cancer Ther. 2014, 13, 275–284.
[3] Moudi, M.; Go, R.; Yong Seok Yien, C.; Nazre, M. Vinca Alkaloids. Int. J. Prev. Med. 2013; 4, 1231–1235.
[4] Ngan, V.K.; Bellman, K.; Hill, B.T.; Wilson, L.; Jordan, M.A. Mechanism of mitotic block and inhibition of cell proliferation by the semisynthetic Vinca alkaloids vinorelbine and its newer derivative vinflunine. Mol. Pharmacol. 2001, 60, 225–32.
[5] Nepali, K.; Sharma, S.; Sharma, M.; Bedi, P.M.S.; Dhar, K.L. Rational approaches, design strategies, structure activity relationship and mechanistic insights for anticancer hybrids. Eur. J. Med. Chem. 2014, 77, 422–487.
[6] Shaveta; Mishra, S.; Singh, P. Hybrid molecules: The privileged scaffolds for various pharmaceuticals. Eur. J. Med. Chem., 2016, 124, 500–536.
[7] Keglevich, P.; Hazai, L.; Gorka-Kereskényi, Á.; Péter, L.; Gyenese, J.; Lengyel, Zs.; Kalaus, Gy.; Dubrovay, Zs.; Dékány, M.; Orbán, E.; Szabó, I.; Bánóczi, Z.; Szántay, Cs. Jr.; Szántay, Cs. Synthesis and in vitro Antitumor Effect of New Vindoline Derivatives Coupled with Amino Acid Esters. Heterocycles 2013, 87, 2299–2317.
[8] Al-Ghorbani, M.; Bushra, Begum A.; Zabiulla, S.; Mamatha, S.V.; Ara Khanum, S. Piperazine and morpholine: Synthetic preview and pharmaceutical applications. J. Chem. Pharm. Res., 2015, 7, 281–301.
[9] Tsepaeva, O.V.; Nemtarev, A.V.; Abdullin, T.I.; Grigor’eva, L.R.; Kuznetsova, E.V.; Akhmadishina, R.A.; Ziganshina, L.E.; Cong H.H.; Mironov, V.F. Design, Synthesis, and Cancer Cell Growth Inhibitory Activity of Triphenylphosphonium Derivatives of the Triterpenoid Betulin. J. Nat. Prod. 2017, 80, 2232–2239.
[10] National Institutes of Health, National Cancer Institute, Division of Cancer Treatment & Diagnosis, Developmental Therapeutics Program, 2019.
https://dtp.cancer.gov/discovery_development/nci-60/methodology.htm
https://dtp.cancer.gov/databases_tools/docs/compare/compare_methodology.htm
