 |
BMe Kutatói pályázat |

|
BME Oláh György Doktori Iskola
BME VBK, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Marosi György
Biohatóanyagok szilárd formulálása elektrosztatikus szálképzéssel
A kutatási téma néhány soros bemutatása
A biotechnológiai eredetű hatóanyagok jelentőségének látványos növekedése jelentős kihívás elé állítja a gyógyszertechnológusokat. A környezeti tényezőkre fokozottan érzékeny biohatóanyagok szilárd formulálása a hagyományos technológiákkal (fagyasztva szárítás, porlasztva szárítás) többnyire csak jelentős aktivitásvesztés mellett, nagy idő- és energiafelhasználással, azaz jelentős költségekkel valósítható meg. Kutatásunk során azt vizsgáltuk, hogy a műanyag- és textiliparban elterjedt, azonban a gyógyszeriparban új technológiának számító elektrosztatikus szálképzés alkalmas-e a jelenlegi vízeltávolítási módszerek kiváltására.
A kutatóhely rövid bemutatása
A Biztonság- Környezet- és Gyógyszertechnológiai (SAFEPHARMTECH) Kutatócsoport olyan anyagtudományi és technológiai kutatások iránt elkötelezett, amelyek az életminőség javítását szolgálják iparágtól független módon. A gyógyszeriparon belül ezt elsősorban a biztonságos, kontrollált, folytonos és integrált gyógyszertechnológia kifejlesztését szolgáló kutatások, a járműipar területén a tűzbiztonság és a megújuló nyersanyagok alkalmazása érdekében végzett kutatások, a környezetvédelem területén a műanyaghulladékok komplex újrahasznosítása formájában igyekszünk megvalósítani.
A kutatás történetének, tágabb kontextusának bemutatása
A XX. század második fele óriási fejlődést hozott a biotechnológia területén, és ez a fejlődés töretlenül folytatódik a XXI. században is. Ennek eredményeként számos új biotechnológiai eredetű hatóanyag jelent meg a gyógyszerpalettán. A biotechnológiai eredetű hatóanyagok, röviden biohatóanyagok, széles csoportjába tartoznak a fehérjék, peptidek, egész sejtek, nukleinsavak, virális részecskék és vakcinák [1]. Ezek közös jellemzője, hogy az előállítás biotechnológiai úton történik, melynek végén a biohatóanyagot az esetek nagy részében vizes oldat vagy szuszpenzió tartalmazza. A biohatóanyagok általában nagy mértékben érzékenyek az őket körülvevő fizikai és kémiai környezetre (hőmérséklet, nyomás, mechanikai stressz, pH, ionkoncentráció, stb.), és kis stabilitásúak vizes közegben [2]. A víz kíméletes elvonása ezekből a rendszerekből a biohatóanyagok stabilitásának jelentős javulásával járhat együtt, ami javítja a termék szállíthatóságát és eltarthatóságát. A víz eltávolítására leggyakrabban a fagyasztva szárítást alkalmazzák [3], melynek során azonban biológiai aktivitáscsökkenés léphet fel, mivel fagyasztás során kisebb-nagyobb jégkristályok alakulhatnak ki, amelyek az érzékeny biohatóanyagok szerkezetét irreverzíbilisen károsíthatják [4]. Emellett a fagyasztva szárítás további igen jelentős hátránya, hogy energia- és időigénye rendkívül nagy [5,6]. A másik, kevésbé elterjedt technológia a porlasztva szárítás, ahol a szárítás fűtött levegővel történik, ami azonban az általában alacsony hőstabilitású biohatóanyagok aktivitásának csökkenését okozhatja. A biohatóanyagok, valamint azok szilárd gyógyszerformáinak jelenlegi és várhatóan tovább erősödő térnyerése a gyógyszerfejlesztésben a gyógyszertechnológiát is új kihívások elé állítja. Ezek közül a kihívások közül a bemutatott megfontolások alapján a szilárd készítmények előállításához szükséges szárítás területén érzékelhető a legnagyobb igény a technológiai fejlődésre.
A kutatás célja, a megválaszolandó kérdések
A kutatás során két, széles körben alkalmazott biohatóanyaggal végeztünk formulálási kísérleteket. A Lactobacillus acidophilus (LBA) egy probiotikus baktérium, mely fontos részét képezi az emberi bakteriális flórának. Számos terápiás alkalmazása mellett napjainkban sikerrel alkalmazzák a leggyakoribb nőgyógyászati [7] megbetegedés a bakteriális vaginosis (BV) kezelésére. A másik biohatóanyag a vékonybél sejtjei által termelt béta-galaktozidáz enzim volt, ami tejcukrot glükózra és galaktózra bontja. A megfelelő mennyiségű enzim hiánya okozza a világ felnőtt lakosságának 75%-át [8] érintő tejcukor érzékenység tüneteit (hányinger, hasi görcsök, puffadás, hasmenés). Azon túl, hogy mindkét biohatóanyag nagy terápiás jelentőséggel bír, jó modellként szolgálnak a – napjainkban leggyakrabban alkalmazott biohatóanyagok – a probiotikumok, illetve az eddig kezelhetetlen betegségekre megoldást nyújtó fehérjegyógyszerek formulálási kísérleteihez
A kutatás célja, a fagyasztva szárítás alternatívájaként, olyan szárítási eljárást találni, fejleszteni, mely alacsony energiaigényű, gyors, termelékeny, lehetőleg folytonos üzemű, és kíméletessége alkalmassá teszi szilárd biohatóanyag formulációk előállítására.
Mindkét biohatóanyag esetében azt vizsgáltuk, hogy a gyógyszertechnológiában újnak számító elektrosztatikus szálképzés, alkalmas-e arra, hogy a vizes oldatból kiindulva minél kisebb aktivitásvesztéssel állíthassunk elő szilárd formát, továbbá, hogy az előállított termékben a biohatóanyag hosszú távon is stabil maradjon.
Módszerek
A Lactobacillus acidophilust két napig 37°C-on MRS Broth-ban fermentáltuk majd centrifugáltuk. Az így kapott szuszpenzióhoz hozzáadtuk a baktériumok szárításánál szokásosan alkalmazott segédanyagokat: trehalózt, szacharózt és sovány tejport. A béta-galaktozidázt az Optiferm bocsátotta rendelkezésünkre, a kiindulási oldat enzimkoncentrációja 0,25 g/ml volt. Ezeket a vizes oldatokat adtuk hozzá a polimeroldatokhoz, melyekből a szálképzést végeztük.
Az elektrosztatikus szálképzés egyszerű és hatékony módszer nagyfinomságú polimer szálak előállítására, melyek átmérője általában 50-1000 nm közé esik. A megvalósítás során kétféle, a gyógyszerügyi hatóságok által elfogadott szálképző polimert alkalmaztunk (poli-vinil-alkohol (PVA), poli-vinil pirrolidon (PVP)). A biohatóanyagokat tartalmazó polimeroldatokat egy elektróddal érintkeztetve nagyfeszültségre (35 kV) töltöttük, a gyűjtőként szolgáló ellenelektródot pedig földeltük. Az így kialakított nagy térerősség hatására a folyadék kúp alakot vesz föl, amit első részletes leírójának tiszteletére Taylor kúpnak neveznek. A kúp hegyéből a nagy töltéssűrűség következtében folyadéksugár léphet ki az ellenpólus irányába, amennyiben a kúp felületén lévő töltések Coulomb taszítása a felületi feszültség visszatartó erejét meghaladja. A kilépő folyadéksugár az ellenpólusú kollektor felé haladva felgyorsul, megnyúlik, elvékonyodik, felülete nagymértékben megnő, és így az oldószer gyorsan elpárolog. A szál alakot felvett és a száradás során megszilárdult polimer végül az ellenpólusú kollektoron összegyűjthető, és leszedhető. Ez a folyamat a másodperc tört része alatt játszódik le, így maga a száradás gyakorlatilag pillanatszerű (1. ábra) [9]. Az előállított mintákat steril, jól zárható mintatartó edényekben 7°C-on tároltuk.
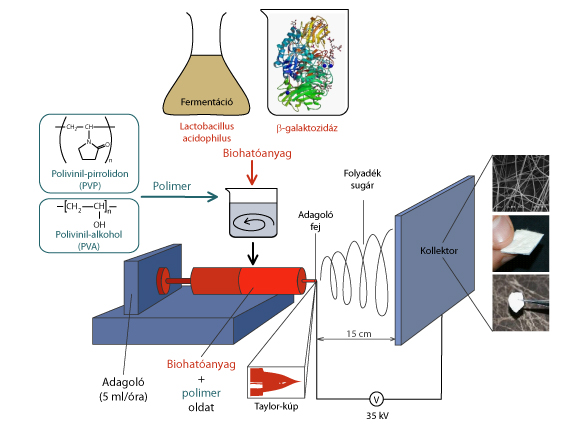
1. ábra: Biohatóanyagok szilárd formulálása elektrosztatikus szálképzéssel
A szálak morfológiai vizsgálatát pásztázó elektronmikroszkóppal (SEM) végeztük. Annak érdekében, hogy pontos képet kapjunk a technológia kíméletességéről, a kiindulási vizes oldatban és a szilárd polimerszálakban egyaránt meghatároztuk a csíraszámot, illetve az enzimaktivitást.
A baktériumokat tartalmazó szuszpenziókat és a szilárd termékeket tömeg szerint mértük be, majd steril vízzel hígítottuk, és hígítási sort készítettünk. Ezután a hígítási sor elemeiből lemezre öntést végeztük, a táptalaj MRS agar volt. Ezt követően a Petri-csészéket, oxigén megkötésére képes anyaggal (Anaerocult) együtt légmentesen zárható tárolóba helyeztük. Ezután 48 órára 37°C-os térbe helyeztük a tárolót, majd az ez idő alatt kifejlődött telepeket megszámolva meghatároztuk az eredeti minta grammonkénti csíraszámát.
Az béta-galaktozidáz aktivitását az enzim által katalizált reakciók nyomon követésével vizsgáltuk. A reakciókat 10 percig, 55°C-on, 4,6-os pH-n állandó kevertetéssel végeztük, majd 1 M-os nátrium-karbonát oldattal állítottuk le. A mérések során kétfajta szubsztrátot az orto-nitrofenil-béta-galaktozidot és a béta-galaktozidáz természetes szubsztrátját, a tejcukrot alkalmaztuk, így két különböző műszerrel is mérni tudtuk az enzim aktivitását. Az orto-nitrofenil-béta-galaktozidot az enzim galaktózra és orto-nitrofenolra bontja, ez utóbbi vegyület lúgos közegben sárga színű, a látható tartományban fényt nyel el, így mennyisége UV-VIS spektrofotométerrel meghatározható. A tejcukorból, a reakció során glükóz és galaktóz képződik, melyek mennyiségének meghatározásához nagy teljesítményű folyadékkromatográfiás (HPLC) analitikát dolgoztunk ki.
Eddigi eredmények
Munkánk során sikeresen állítottunk elő biohatóanyagot tartalmazó polimer szálakat. Mindkét szálképző polimer esetében megfigyelhető, hogy a polimer szálak körbevonták a baktériumokat, mintegy burkot, bevonatot képezve azok körül, míg az enzimtartalmú szálaknál kisebb csomók figyelhetők meg (2. ábra). Több esetben megfigyelhető volt összetapadt baktériumok megjelenése a nanoszálas termékekben, ami azt mutatja, hogy a szálképzés során fellépő, a baktériumokra gyakorolt nyújtóerők nagysága nem érte el azt a szintet, ami elég nagy lett volna a sejtosztódáskor összetapadt baktériumok szétválasztásához. Ez azt is mutatja, hogy a baktériumok feltehetőleg csak mérsékelt mechanikai stressznek vannak kitéve a szálak elvékonyodása során.

2.ábra: Polimerszálakba ágyazott biohatóanyagok (A: Lactobacillus acidophilus PVA-ban, B: Lactobacillus acidophilus PVP-ben, C:béta-galaktozidáz PVP-ben)
Mindemellett a pásztázó elektronmikroszkópos vizsgálatok tanúsága szerint a polimer szálak átmérője nem változott meg a baktériumok jelenlététől, eltekintve azoktól a részektől, ahol a biohatóanyagokat körbevonta a szálképző mátrix. A placebo szálakhoz hasonló szálátmérők arra utalnak, hogy az elektrosztatikus szálképzési eljárást a biohatóanyagok jelenléte a polimer oldatban lényegében nem befolyásolta. Ez a méretnövelhetőség szempontjából igen biztató, hiszen a vizes PVA és PVP alapú nanoszálképzési technológiák méretnövelésével kapcsolatban már komoly előrelépések történtek [10, 11].
A célkitűzés szempontjából a legfontosabb, hogy a beágyazott biohatóanyagok aktivitása, azaz a baktériumok életképessége és szaporodóképessége, valamint a béta-galaktozidáz tejcukor bontó hatása megmaradjon, ezáltal alkalmasak legyenek a bacterialis vaginosis és a tejcukor érzékenység kezelésére.
A szálképzést követő mérések azt mutatták egyik biohatóanyag esetében sem jelentkezett szignifikáns aktivitáscsökkenés, tehát az elektrosztatikus szálképzéssel sikeresen állítottunk elő olyan szilárd polimer szövedékeket, melyekben a kiindulási oldathoz viszonyítva a biohatóanyagok aktivitása közel 100%-os volt.
Mivel a gyógyszerekkel szemben támasztott alapvető követelmény, hogy hatásuk sokáig biztosított legyen, vizsgáltuk, hogy a szálakban hogyan változik a biohatóanyagok aktivitása. Egy év után a Lactobacillus acidophilust tartalmazó minták 1 mg-ja több mint 1 millió aktív baktériumot tartalmazott, tehát már 1 mg is tartalmazta a hatásos dózist. Figyelemre méltó eredmény továbbá, hogy az egy év alatt az élő baktériumok száma csupán harmadára csökkent, míg az ebben a tárgykörben megjelent publikációk [4, 12] a fagyasztva szárítással előállított szilárd termékek esetében már egy évnél rövidebb idő alatt is egy vagy több nagyságrendnyi csökkenést említenek. Ez a kiugróan jó eredmény a kíméletes szárítási körülményeken túlmenően az elektrosztatikus szálképzés során kialakult polimer burok védőhatásának tulajdonítható. Az enzimtartalmú szálak aktivitása egy év alatt nem változott, a szálakba ágyazott enzim megőrizte aktivitását, ebben az esetben kb. 20 mg polimer szál tartalmazza a hatásos dózisnak megfelelő enzimmennyiséget. Munkánk során tehát olyan polimer szálakat tudtunk előállítani melyekben a biohatóanyagok hosszú távon is képesek megőrizni aktivitásukat, ami azt jelenti, hogy az elektrosztatikus szálképzés valós alternatívája lehet a hagyományos szárítási technológiáknak.
Várható impakt, további kutatás
A kísérletek eredményei azt mutatják, hogy az elektrosztatikus szálképzéssel a hagyományos szárítási technológiáknál kíméletesebb körülmények között jelentős aktivitásvesztés nélkül állíthatók elő szilárd, stabil biohatóanyagot tartalmazó polimerszálak. A megkezdett munka folytatásaként a formulálás méretnövelhetőségét vizsgáljuk. Napjainkban már napi 10 kg PVA szál előállítása is megoldott, tehát amennyiben a méretnövelés során jelentős aktivitásvesztés nem tapasztalható, elektrosztatikus szálképzéssel nagy mennyiségű, hatásos dózist tartalmazó egység állítható elő. Ezen túlmenően új, szintén nagy terápiás jelentőséggel bíró biohatóanyagok formulálási lehetőségét is vizsgáljuk, különös tekintettel az egyre nagyobb számban megjelenő fehérjegyógyszerekre (pl. monoklonális antitestek).
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája
I. I. Wagner, Nagy Z. K., Á. Suhajda, T. Tobak, A.H. Harasztos, H. Pataki, G. Marosi, Solid Dosage Form of Living Bacteria Prepared by Electrospinning. New Biotechnology. (2013) if.: 1,706 (beküldve)
II. I. Wagner, H. Pataki, A. Balogh, Z.K. Nagy, A. H. Harasztos, Á. Suhajda, G. Marosi, Electrospun nanofibers for topical drug delivery. European Journal of Pharmaceutical Sciences, 44, Suppl. 1: 148 (2011) if: 3,291
III. Z.K. Nagy, A. Balogh, I. Wagner, P. Sóti, H. Pataki, K. Molnár, G. Marosi, Nanofibrous drug delivery systems for enhanced dissolution prepared by electrospinning. European Journal of Pharmaceutical Sciences, 44, Suppl. 1: 152-153. old. (2011) if: 3,291
IV. Z.K. Nagy, K. Nyúl, I. Wagner, K. Molnár, G. Marosi, Electrospun water soluble polymer mat for ultrafast release of Donepezil HCl. Express Polymer Letters 4: 763–772. old. (2010) if: 1,575
Hivatkozások listája
[1] D.A. Parkins, U.T. Lashmar, The formulation of biopharmaceutical products. Pharmaceutical science & technology today. 3:129-137. old. (2000)
[2] Y.F. Maa, S.J. Prestrelski, Biopharmaceutical powders particle formation and formulation considerations. Current Pharmaceutical Biotechnology. 1:283-302. old. (2000)
[3] S.M. Patel, M.J. Pikal, Emerging Freeze-Drying Process Development and Scale-up Issues. AAPS PharmSciTech. 12:372-378. old. (2011)
[4] C. Morgan, N. Herman, P. White, G. Vesey, Preservation of micro-organisms by drying; a review. Journal of microbiological methods. 66:183-193. old. (2006)
[5] C. Ratti, Hot air and freeze-drying of high-value foods: a review. Journal of Food Engineering. 49:311-319. old. (2001)
[6] S. Rudy. Energy consumption in the freeze- and cenvection-drying of garlic. TEKA Kom Mot Energ Roln - OL PAN. 9:259-266. old. (2009)
[7] J.E. Allsworthand J.F. Peipert, Prevalence of bacterial vaginosis: 2001-2004 national health and nutrition examination survey data. Obstetrics & Gynecology. 109:114 (2007)
[8] D.M. Paige, Lactose Intolerance. Encyclopedia of Human Nutrition (Third Edition), Pages 67–73 (2013)
[9] J. Doshi, D.H. Reneker, Electrospinning process and applications of electrospun fibers. Journal of electrostatics. 35:151-160. old. (1995)
[10] C.S. Kong, W.S. Yoo, K.Y. Lee, H.S. Kim, Nanofiber deposition by electroblowing of PVA (polyvinyl alcohol). Journal of materials science. 44:1107-1112. old. (2009)
[11] R. Weitz, L. Harnau, S. Rauschenbach, M. Burghard, K. Kern, Polymer nanofibers via nozzle-free centrifugal spinning. Nano letters. 8:1187-1191. old. (2008)
[12] G. Zayed, Y. H. Roos, Influence of trehalose and moisture content on survival of Lactobacillus salivarius subjected to freeze-drying and storage. Process Biochemistry 39: 1081-1086. old.
